CRISPR∕Cas9基因编辑技术
导读
CRISPR/Cas(Clustered Regularly Interspaced Short Palindromic Repeats),是细菌和古细菌为应对病毒和质粒不断攻击而演化来的获得性免疫防御机制,其主要功能是对抗入侵的病毒及外源DNA。科学家利用CRISPR/Cas系统可以对多种细胞的特定的基因组位点上进行切割,以便插入新的遗传物质。在需要对目的基因的功能进行破坏,或者要进行目的基因替换时都可以使用CRISPR/Cas系统,可以像编辑文字一样编辑基因,因此被称为基因编辑技术。
本技术具有简便、快捷、精准等优点,于2016年获得被喻为“豪华诺贝尔奖”的生命科学突破奖。CRISPR/Cas的开发为构建更高效的基因定点修饰技术提供了全新平台。
CRISPR/Cas9 原理
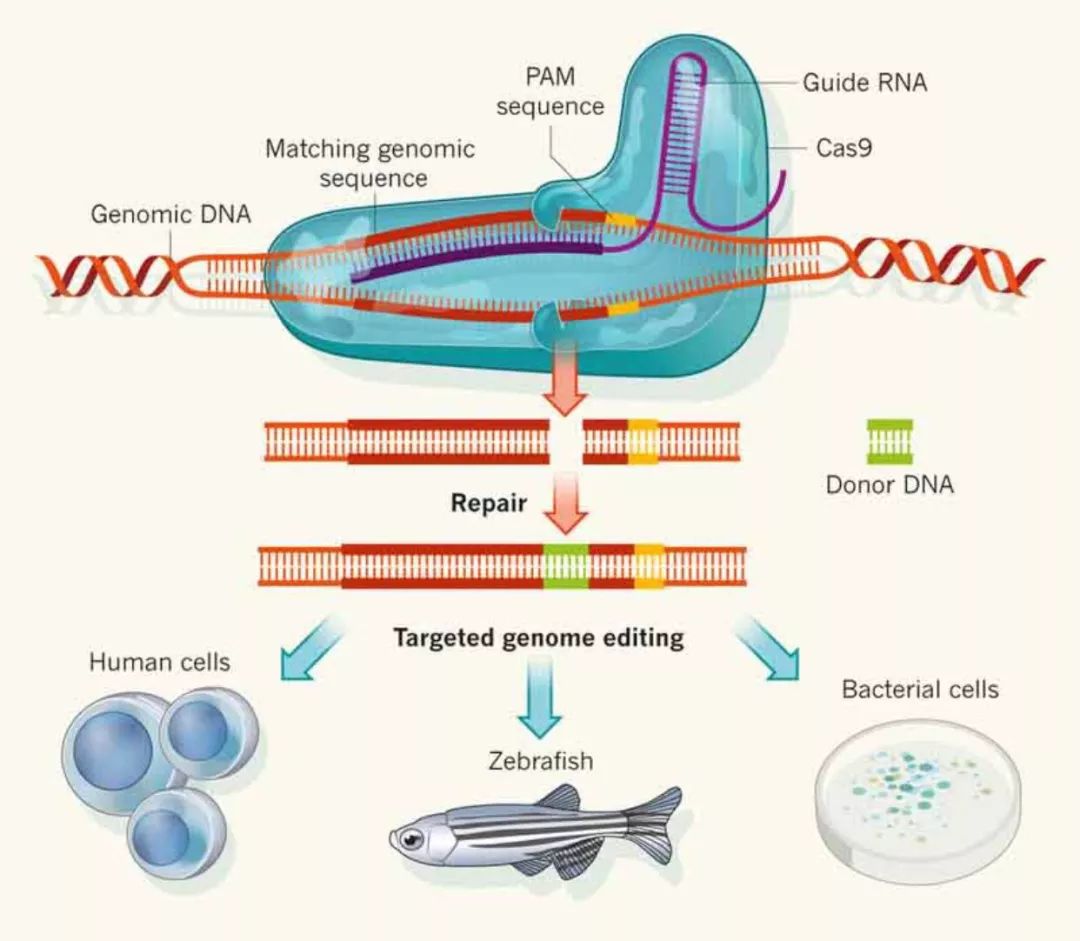
在细菌和古菌中,crRNA(CRISPR-derived RNA)通过碱基配对与tracrRNA(trans-activating RNA)结合形成双链RNA,此tracrRNA/crRNA二元复合体指导Cas9蛋白在crRNA引导序列的靶定位点剪切双链DNA,从而达到对基因组DNA进行修饰的目的。
科学家们设计一段小向导RNA(small guide RNA, sgRNA),将这段sgRNA导入细胞中。CRISPR靶向特异性是由两部分决定的,一部分是此sgRNA和靶DNA之间的碱基配对,另一部分是Cas9蛋白和一个短DNA序列,这个短的DNA序列通常在靶DNA的3'末端发现,被称为protospacer adjacent motif(PAM)。
sgRNA与靶DNA结合,招募Cas9内切酶形成复合物,Cas9内切酶则切割,断裂DNA双链。而当真核细胞识别到的DNA双链断裂后,通常启动两种途径进行DNA修复,分别为非同源末端结合(non-homologous end joining,NHEJ)和同源介导的双链DNA修复(Homology directed repair,HDR)。NHEJ机制是细胞体内DNA修复最活跃的一种方式,直接将双链断裂末端的ssDNA拉近,再借助DNA连接酶等相关酶将断裂的ssDNA重新接合。在接合的过程中很容易造成碱基缺失或者插入,从而造成移码突变(frameshift mutations),最终导致该基因的开放阅读框(open reading frame)发生改变,蛋白质无法翻译或者失去功能,达到了基因敲除(Knock-out)的目的。
CRISPR/Cas9原理
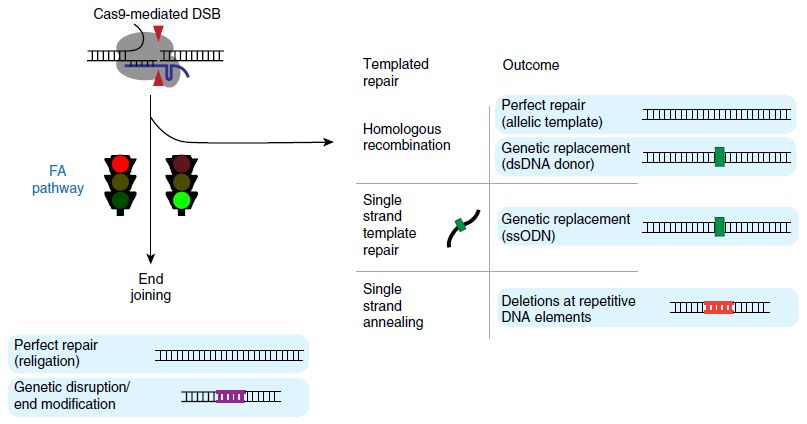
最近,科学家们又发现了CRISPR/Cas9切割DNA后修复的另一影响因素:Fanconi anemia(FA)通路[1]。此通路涉及的关键基因,与一种罕见贫血症──Fanconi anemia相关,由此得名。在人细胞中,CRISPR/Cas9切割DNA后,如有外源单链DNA(如合成的oligo dT)模板,则会发生单链模板修复(single-strand template repair, SSTR),这个过程需要FA通路的众多分子参与。其中,FANCD2蛋白在CRISPR/Cas9产生的双链断裂位点上富集。科学家们猜测,在CRISPR/Cas9切割DNA后修复中,FA通路起到“交通灯”的作用:当FA通路不活跃时,修复将导向“无模板”方向,发生NHEJ;当FA通路活跃时,修复将导向“有模板”的方向,发生HDR或SSTR。
在CRISPR/Cas9切割DNA后修复中,FA通路的“交通灯”的作用
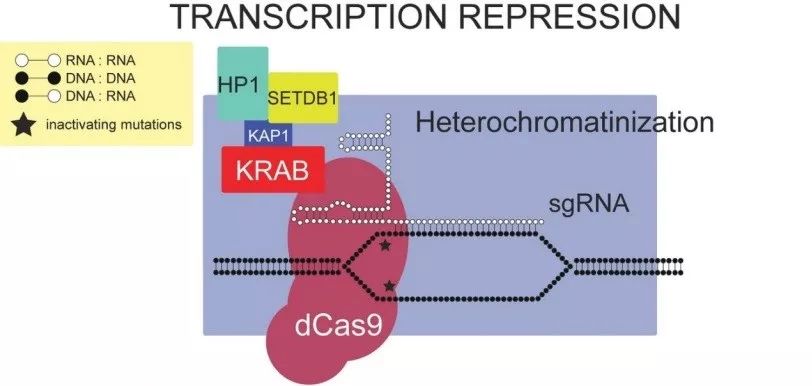
科学家们还有一种利用CRISPR系统进行基因敲降(Knock-down)的方法:将体系里的Cas9突变成dCas9(dead Cas9),它没有切割DNA活性。在目标基因启动子区域或者增强子区设计sgRNA,引导dCas9蛋白靶向结合该基因的启动子区域的DNA。则该位置被dCas9“占据”,基因转录被抑制。还可将转录抑制肽KRAB repressor融合的dCas9蛋白的C端,使转录抑制更强化。这种技术称作CRISPR interferance(CRISPRi)。在人细胞中,CRISPRi的转录抑制效率可高达90%或以上。
CRISPRi原理
今年8月,关于CRISPR∕Cas技术,德克萨斯大学奥斯汀分校的科学家们又有一则新的发现:CRISPR基因编辑系统中第一个且应用最普遍的Cas9酶,在效力和精确度低于另一种应用较少的Cas12a酶。相关研究成果于8月2日发表在Cell子刊《Molecular cell》上[2]。9月,又有一项新的发现:CRISPR/Cas技术有直接编辑大量体细胞基因组的能力!将带有CRISPR/Cas9的腺病毒注射进杜氏肌营养不良症小狗的一处骨骼肌中。6周后,取注射过腺病毒的肌肉组织进行检测。对肌肉组织的进行检测发现,正常功能的Dstrophin蛋白表达量达到了正常小狗肌肉组织的60%,而未注射得病小狗的只有2%,恢复非常明显!这展示了其用于基因治疗的良好前景。相关研究成果发表在Science上[3]。CRISPR技术现在热度十足,新发现层出不穷。等待一段时间,一定会沉淀出更好更实用的更新。我们会一直追踪,并报道给大家。
实现基因编辑的若干方法
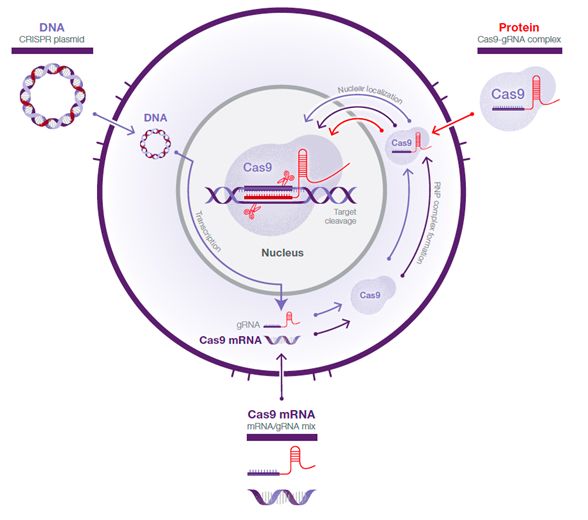
CRISPR/Cas9基因敲除及CRISPRi,根据原理,其实现方法是在细胞内产生出一段小RNA(sgRNA)及Cas9蛋白质,引导细胞进行基因编辑。
可以在体外合成sgRNA和Cas9蛋白质,一同转染细胞后,在体内形成复合物,行使其功能。也可以在体外用DNA模板转录生成sgRNA,与Cas9蛋白质,一同转染细胞后,在体内形成复合物,行使其功能。而Cas9,也可以mRNA的形式转入细胞中再翻译成蛋白质。
应用最广泛的,是用质粒转染细胞。质粒在细胞内转录形成sgRNA和Cas9的mRNA,再翻译形成Cas9蛋白。sgRNA、Cas9蛋白可以用不同的质粒表达,或者用同一质粒表达。 Addgene可以提供这些质粒。为了更快地进行sgRNA的筛选,可以用带有sgRNA序列的DNA片段(来自PCR)来代替sgRNA的质粒,也可以构建慢病毒载体,感染细胞筛选稳转株,进行长时间的稳定表达。
实现基因编辑的若干方法
参考文献:
1 Richardson CD et al. CRISPR-Cas9 genome editing in human cells occurs via the Fanconi anemia pathway. Nat Genet. 2018 Aug;50(8):1132-1139.
2 Isabel Strohkendl et al. Kinetic Basis for DNA Target Specificity of CRISPR-Cas12a. Molecular Cell 2018
3 Leonela Amoasii et al. Gene editing restores dystrophin expression in a canine model of Duchenne muscular dystrophy. Science 30 Aug 2018
作者:招财猫