基因编辑婴儿还有多远?
迄今为止,还没有哪项生物技术像基因编辑技术一样应用如此广泛和快速。按照目前的进展速度,尽管“基因编辑”婴儿的出现还需要一些时日,但是技术层面的问题将很快实现突破,而基因编辑治疗人类疾病的临床应用早已启动,并取得了一些成效。
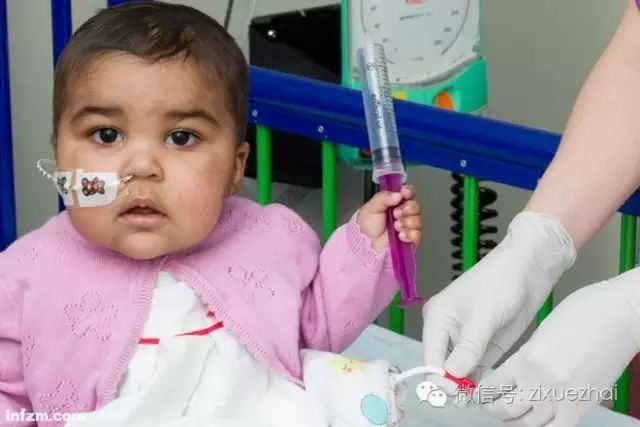
接受基因编辑治疗后的白血病女婴莱拉。(南方周末资料图/图)
迄今为止,还没有哪项生物技术像基因编辑技术一样应用如此广泛和快速。按照目前的进展速度,尽管“基因编辑”婴儿的出现还需要一些时日,但是技术层面的问题将很快实现突破,而基因编辑治疗人类疾病的临床应用早已启动,并取得了一些成效。
英国《自然》杂志2016年11月15日报道,中国成都华西医院的医生对一名严重肺癌患者实施了一种特殊疗法,将经基因编辑技术改造的免疫细胞注射回患者体内,以帮助治疗癌症,这是国际上首次将基因编辑技术用于癌症的临床治疗,再次为近年来越来越火爆的“基因编辑”技术注入新的能量,也为人类攻克癌症、艾滋病和遗传病带来新的希望。
“基因编辑”风暴
人类很多疾病都与基因突变有关,如果能将突变的基因“拨乱反正”,将有望根除这些致命的遗传病。研究发现,艾滋病、癌症等恶性疾病也都可以通过改良人体免疫细胞中某些基因加以治疗。为此,科学家们一直在寻找能消灭这些疾病的终极武器,不过几十年来的苦苦寻觅,收效甚微。
直到近几年,科学家从细菌身上找到了一些“基因编辑”工具,让这种根治人类遗传病和其它恶性疾病的想法有可能变成现实。这些基因编辑工具其实是存在于细菌和古菌体内的一种防御系统,能对入侵细菌基因组的病毒DNA进行精准的删除或改写,精确程度就像利用word软件对近十亿字的中国古典巨著《四库全书》进行一个词语甚至是一个字的编辑。
科学家对这些基因编辑工具进行一些改造,就变成现在生命科学研究领域广泛使用的基因编辑技术,主要包括锌指核酸酶(ZFN)技术、类转录激活样效应因子核酸酶(TALEN)技术和最近发展起来的CRISPR/Cas9技术。这些基因编辑工具均含有两个组件,一个是特异识别和结合目标DNA序列的组件,相当于word软件中的“查找”工具,可以定位到某个特定词语,另一个则是负责对目标DNA进行剪切修饰的核酸内切酶,相当于word软件中的“剪切”工具,能轻松剪切掉这个特定词语。所不同的是,前两种基因编辑技术的“查找”工具是蛋白质,设计和制作成本较高,而CRISPR/Cas9技术是通过RNA来寻找靶向序列,由于设计RNA比蛋白质简单,这项技术迅速走红起来,基因编辑技术也像“风暴”一样席卷整个生命科学领域。迄今为止,还没有哪项生物技术像基因编辑技术一样应用如此广泛和快速。
基因编辑技术示意图。(南方周末资料图/图)
人类细胞首当其冲
对人类细胞进行基因改造是实施基因治疗的第一步,也是探索基因编辑治疗疾病可行性的基础。
11月7日,英国《自然》杂志发表了美国斯坦福大学研究人员最新研究成果,他们利用CRISPR/Cas9基因编辑技术,在体外成功修复镰状细胞贫血患者造血干细胞中的致病突变基因——β珠蛋白基因,利用研究人员建立的浓缩技术,可让修复的干细胞比例达90%以上,这些修复的造血干细胞在分化成红细胞后,也能表达出正常的血红蛋白。10月12日,美国《科学转化医学》杂志也报道了美国加利福尼亚大学伯克利分校等类似的研究,该研究小组除了对人造血干细胞进行基因改造,还将已改造的人造血干细胞注入小鼠体内,发现这些干细胞可在小鼠体内存活至少16个星期。这些研究表明,这种基因编辑过的人造血干细胞有望帮助镰状细胞贫血患者改善病情。
2016年3月,《科学报告》杂志报道了来自美国天普大学一项令人振奋的研究成果,研究人员利用CRISPR/Cas9技术将潜伏于艾滋病人T细胞基因组中的HIV病毒基因删除,这些基因编辑过的T细胞仍然能正常生长,但是其中的HIV病毒载量降低了90%,有望未来三年左右应用于艾滋病的治疗。其实在2015年11月,美国《科学》杂志曾经报道过,美国哈佛大学研究人员同样利用CRISPR/Cas9技术,将潜伏在猪基因组中的内源性逆转录病毒一次性全部删除,不仅重新开启猪异种器官移植的希望,也为同为逆转录病毒引起的艾滋病治疗提供了参考。
编辑人类胚胎引发争议
在动物和人类细胞上开展各种基因编辑技术研究之后,有些科学家抵不住诱惑,进行了人类胚胎基因编辑的大胆尝试,中国科学家冲到了最前面,但是由于该项新技术尚不成熟,这种大胆的研究引发了国内外科学家同行和公众的普遍疑虑和担忧,甚至人们担心是否会出现基因编辑婴儿。
2015年4月,我国中山大学黄军研究员团队首次在学术杂志《蛋白质与细胞》上公布了对人类胚胎进行CRISPR/Cas9基因编辑的消息。不过研究人员采用的是医院丢弃的问题胚胎,并不能成功孕育出婴儿。该研究的主要目的是对导致β型地中海贫血进行基因编辑,以研究治疗或根除β型地中海贫血的可能性。
该研究是国际上首次关于人类胚胎基因编辑的报道,激起了科学界和公众的激烈讨论,黄军研究员也入选国际著名学术期刊《自然》评选的2015年度对全球科学界产生重大影响的十大人物。
由于担心基因编辑技术对人类生殖上的滥用,美国、欧洲、日韩以及中国等国家的该领域权威科学家们自发组织起来,在华盛顿召开了“国际人类基因编辑大会”(International Summit on Human Gene Editing),经过激烈讨论,与会科学家形成共识:应继续开展基因编辑技术的基础和临床前期研究,但是将尚不成熟的基因编辑技术应用于人类生殖是不负责的。
不过,科学家们利用基因编辑技术开展人类疾病治疗研究的热情并没有完全被浇灭。2016年4月,广州医科大学附属第三医院范勇博士领导的团队公开了第二例基因编辑人类胚胎的研究进展,据他们发表在《辅助生殖与遗传学期刊》的学术论文显示,从2014年4月至9月,研究人员从87名志愿者那里收集了213枚三原核受精卵,三原核受精卵属于人工授精技术中不能正常发育成胎儿的问题胚胎,因此常被用于人类生殖的基础研究。研究人员采用CRISPR/Cas9工具,对这些三原核受精卵中的基因CCR5进行编辑,共获得4个对HIV病毒抵抗力显著增强的突变型胚胎,并在三天内对这些胚胎进行了销毁。这项研究同样引起了国际顶级学术期刊《自然》《科学》以及众多媒体的广泛关注。
然而根据《自然》杂志的预测,并非只有中国科学家如此超前,其实国际上很多科学家已开展了类似的研究,有些似乎走得更超前。据美国国家公共电台9月26日报道,瑞典卡洛林斯卡研究所的弗雷德里克·兰纳(Fredrik Lanner)博士首次采用CRISPR/Cas9技术对健康人的胚胎进行了基因编辑,期望找到治疗不孕不育和流产的新方法,以及发展胚胎干细胞疗法来治疗很多人类疾病。兰纳博士团队已对十几个胚胎进行基因编辑操作,这些研究仍在进行之中,最终结果也有待在学术杂志上发表。不过兰纳博士表示这些基因编辑胚胎最长存活时间将不超过14天。
尽管存在较大争议,对于开展人类基因编辑的基础研究还是普遍被接受的,而且从这些前期研究来看,这些先行的科学家们也充分考虑到技术的成熟度和伦理问题,用于试验的人类胚胎要么来自有问题不能发育的胚胎,要么是主动控制胚胎存活时间。
鉴于基因编辑技术的强大,很多科学家和公众担心这些技术会被秘密用于人类生殖。目前基因编辑技术的最主要问题是存在脱靶效应,即这些基因编辑工具除了对目标DNA序列进行编辑之外,还可能对基因组中与目标序列相近的DNA序列进行修饰,如果不能筛检出这些意外基因突变,可能导致“基因编辑”婴儿出现各种不可预测的问题。即使技术足够成熟,与线粒体替换疗法中的“三亲婴儿”一样,也面临对人类进行基因改良制造超人的担忧。
受致命遗传病困扰,很多不孕不育家庭的唯一动力可能就是拥有一个健康的宝宝,对他们来说,并不愿意轻易放弃任何有可能圆梦的希望,而对科学家们和医生们来说,除了加快基因编辑技术的基础研究,扫除其安全应用的技术障碍,还需要接受道德和法律的约束。2016年2月,英国已批准开展人类胚胎基因编辑研究申请,其他国家也正在研究立法对人类胚胎基因编辑研究进行规范和引导。
临床治疗早已启动
按照目前“基因编辑”风暴的速度,尽管“基因编辑”婴儿的出现还需要一些时日,但是技术层面的问题将很快实现突破,而基因编辑治疗人类疾病的临床应用早已启动,并取得了一些成效。
据2014年3月《新英格兰医学杂志》披露,来自美国宾夕法尼亚大学和美国Sangamo生物技术公司的研究人员利用锌指酶(ZFN)技术对艾滋病人CD4 T细胞中的CCR5基因进行编辑,并将这些基因编辑CD4 T细胞注射到12名艾滋病人体内,一周后患者血液CD4 T细胞大幅度增加,多数患者的HIV DNA水平显著下降,其中有一名患者血液检测不到HIV RNA。随着这一尝试的成功,美国Sangamo生物技术公司已启动了对另外70位艾滋病患者的类似临床试验,有望为科学界开辟一条治愈艾滋病的新途径。
2015年11月5日,英国《自然》杂志报道了一个基因编辑技术治疗白血病女婴的案例。这个一岁的女婴名叫莱拉(Layla),被诊断患有白血病,之前多次常规治疗均告失败。在无计可施之际,莱拉的父母同意伦敦大奥蒙德街医院的医生采用基因编辑新疗法放手一搏。医生们将事先经TALEN编辑的健康捐献者的T细胞注射到莱拉血液中,很快莱拉的病情出现好转。
不过莱拉的主治医生指出,这些方法并非治愈白血病的最终方案,因为研究人员只是对健康捐献者的T细胞某些引起免疫排斥反应的基因进行了删除,以防止这些外来T细胞被病人自身的免疫系统和抗癌药物的攻击,从而提升女婴的免疫能力,争取更多的治疗时间。莱拉的主治医生还计划对另外10-12个白血病病人采取相同的治疗方法。
在基因编辑临床应用方面,中国科学家也不甘落后。据英国《自然》杂志11月15日报道,来自中国四川大学华西医院肿瘤科主任卢铀的团队在国际上率先开展了一例基因编辑治疗肺癌的临床研究,研究人员从一名转移性非小细胞肺癌患者血液中提取出免疫T细胞,利用CRISPR/Cas9技术对该细胞负责编码PD-1蛋白的基因进行删除,以使其失去活性。正常情况下,肿瘤细胞会分泌一种蛋白与免疫T细胞表面的PD-1蛋白结合,免疫T细胞则无法识别并攻击肿瘤细胞,肿瘤细胞得以快速增值。将PD-1基因删除后,T细胞就能正常识别肿瘤细胞,并向免疫系统发出攻击肿瘤细胞的信号。研究人员将这些经改良的T细胞体外培养后,重新注射回患者体内,有望协助患者免疫系统清除肿瘤细胞,预计6个月后可以观察到最终疗效。据《参考消息》了解,本次临床试验还有另外9位癌症患者等待接受同样的疗法,在经历放疗和化疗无效后,他们期待新的疗法能带来重生的希望。
除此之外,美国宾夕法尼亚大学和北京大学的研究团队也计划分别于2017年上半年开展类似的癌症治疗临床试验。随着这些临床应用的深入开展并取得预期疗效,“基因编辑”风暴势必日趋强劲。(来源:南方周末)
基因编辑人类还有多远?
操纵基因的新技术前景广阔,但需要规则来规范其使用。
基因组用短短的四个字母就能书写(注:四个字母分别是G、C、A、T。G 鸟嘌呤(guanine)脱氧核苷酸、C 胞嘧啶(cytosine)脱氧核苷酸、A 腺嘌呤(adenine)脱氧核苷酸、T 胸腺嘧啶(thymine)脱氧核苷酸)。能读取、研究并比较人类和数千种其他物种的DNA序列已司空见惯。一项新技术承诺能快速使其能够以低廉的价格快速地编辑遗传信息。这可以纠正摧残生命的可怕的遗传缺陷,也预示着家长可以凭订购指令打造自己孩子的遥远前景。
该技术被称为CRISPR-Cas9技术,或者仅称为CRISPR技术。它涉及到一片核糖核酸(RNA)和称为核酸酶的酶,核糖核酸是一个化学信使,目的是形成一段DNA;核酸酶可剪掉不需要的基因并粘贴新基因。存在其它编辑DNA的方式,但CRISPR技术有望以前所未有的简便程度、速度和精确度完成这项工作。
应用范围令人眼花缭乱,使得研究人员将目光转向CRISPR技术以开发包括从老年痴呆症到癌症、再到艾滋病等一切疾病的治疗方案。由于能让医生把合适的捕捉癌症基因放入到患者的免疫系统,该技术可能会为肿瘤治疗带来新方法。此外,该技术也可能加速基因治疗的进程,在该治疗过程中,医生把正常基因放入到罹患遗传性疾病,如Tay-Sachs病(注:一种与神经鞘脂代谢相关的隐性常染色体遗传病)或囊肿性纤维化疾病的患者细胞里面。
也许需要数年甚至数十年,CRISPR技术才能被用来设计婴儿。但是,由此引发的问题已经引发了激烈讨论。四月份,中国科学家透露,他们已尝试用CRISPR技术编辑人类胚胎的基因组。虽然这些胚胎不能发育至足月,但是由于治疗或非医学增强原因,活胚可能有一天会被设计出来。
这就是一条有些人不愿意越过的障碍。许多科学家,其中包括CRISPR技术的发明者之一,希望中止编辑繁衍后代的“种系”细胞。美国国家科学院计划举行会议深入研究CRISPR技术的道德问题。这场辩论是迫切需要的。 CRISPR是一个福音,但它提出了深刻的问题。
道德是唯一的解决办法
这些问题归结为两类:实际问题和哲学问题。直接的障碍是实际问题。在剪切目标DNA的同时,CRISPR也常常在其他器官找到目标。在实验室中,这可能无关紧要;但在人体里,它可能造成严重的伤害。对于一位患有可怕疾病的人而言,附带损害的风险可能值得研究。但是,在种系细胞应用中,每一个细胞都会感知到副作用,则障碍面应当会很高。可能要用一代人的时间才能确保这种技术是安全的。届时,患有基因疾病的夫妇可以利用体外受精来怀孕,并选择健康的胚胎。
再者,尽管基因序列数据泛滥,但是生物学对于人类几乎所有的有趣且复杂的特征的起源却知之甚少。只有很少几个特征可能很容易用快速的剪—贴方式来强化。将来在各种能力之间会常常存在权衡。按所提供的属性选择似乎还有很长的路要走。不过,科学带来进步——确实,正如基因序列所示,科学有的时候的确是在飞速发展。因此,科学家现在就去考虑监管CRISPR的最佳方式是对的。
这意味着对那些哲学方面的问题的回答。总有一些因为这种技术让人类扮演上帝而会反对CRISPR的人。但是,药物干预事物的自然秩序已司空见惯——例如,将人们从各种感染和寄生虫中拯救出来的行为。治疗癌症、将儿童从各种基因疾病中拯救出来以及为了解糖尿病的治愈机会都为推动这个进程提供了正当理由。
一个更难的问题是:以编辑人类种系细胞的方式,对继承而来的东西加以改变是否永远是正确的。这在40个国家是被明令禁止的,在许多地方也是予以限制的。没有理由禁止对其进行研究或者是治疗性使用:有些国家允许对人类胚胎进行研究,只要它们是体外受精剩下的,而且其生长期没有超过14天,这是对的。英国已经允许捐赠人在怀孕时提供线粒体DNA,以便让儿童免遭不必要的痛苦,即便是改变会被传承下去。CRISPR面对的反对意见是,种系改变是不可逆的:如果基因能在编辑中删除,它们最终还是可能在编辑的时候被逆转回去。
一个更深层次的困惑与利用CRISPR对个人基因组进行任意的调整。这会让治疗(比如,去除那些更有可能引发乳腺癌或者早发型阿尔茨海默症的基因)逐渐发展成为基因强化。有的人可能认为短浅或不考虑长远是待需要修正的问题。但是,在这个方面,正确的做法也应该是以谨慎而开明的态度:社会应该承担证明何时以及为什么进行基因编辑是错误的责任。
CRISPR,更快乐,更能生
利用这些原则制定法规不会很快就会实现。有些国家可能在立法或者糟糕的执法方面存在差距,允许私人资助的科学家或者是私人生育诊所进行不接受监管的CRISPR研究。英国人类受精与胚胎管理局在其有关线粒体DNA的决定中所采取的保守和谨慎策略是一个样板。监管方还必需监视CRISPR在非人类物种上的使用。改变动物的基因组以传播令人满意的特征——如无法传播疟疾的蚊子——能够带来巨大的好处。但是,意外后果的风险意味着这种“基因推动”应当被禁止,除非它们能够被已得到证明的对策给扭转过来。
如果CRISPR能够被证明用于人体是安全的,则也需要各种机制来争取同意和平等。基因编辑带来了父母做出不是明显地最有利于他们的孩子的选择的担忧。比如说,聋哑的父母可能更倾向于他们的后代也是聋哑人;有抱负的父母可能想不惜代价提高孩子的智力,即便这会以其他方式影响孩子的人格。再者,如果稍稍改进基因让孩子变得更聪明成为可能,只有富人具有选择权吗?
认真思考这些问题是正确的。但是,这些困难不应当埋没CRISPR的好处,或是阻碍它的进步。一种能够让人类过上更健康、更长寿和更优质的生活的工具在世界上触手可及,它应当得到人们的接受。(来源:生物谷Bioon.com)