基因治疗的前世今生(八):编程时代(中)
“神话”蛋白:但开风气不为师
话说清末学人龚自珍有名句“但开风气不为师”,说自己只用诗文引领潮流,但绝不开馆授徒、用朋党影响政治。这句诗后来被中国新文化运动的奠基人之一胡适先生引用,用自嘲的口吻说自己但开文学革命风气之先,成就却难称一代宗师之誉。其实想想也不奇怪,虽说人类的群星闪耀是历史进步的重要源泉,然而历史的演进总是有她自身缓慢却坚决的步点,一个天才可以既披荆斩棘在旧思想的牢笼上剪破一道缺口,又总领新思维的全局皇皇成一代宗师的可能性确实太小太小了。
我们上回书中讲到的主角“神话”蛋白(TALE),恰恰也是这么个但开风气不为师的角色。
它一手开启了人类基因组的编程时代,让科学家们可以用相对快捷精准的方法定位和编辑人类基因组。相比它的前辈锌手指蛋白,科学家们不再需要经历繁琐的筛选和组装步骤才能保证对基因组的准确定位,只需要在计算机上把几种“神话”蛋白按照基因组DNA的编码顺序串联起来就可以在理论上完成组装工作。简单类比一下同样飞速进化的人类通讯手段,这等于把基因组定位的难度,从马可尼时代直接带入山寨机时代,本来要依靠体格庞大的发报机和滴滴答答的莫尔斯代码才能实现的信息传递,一夜过后靠低技术的流水线组装就可以更高效和准确的实现了!
同时,开发“神话”蛋白组装技术的科学家们,这一回充分的吸取了锌手指蛋白被专利禁锢的教训,几乎总是在第一时间分享和公开新的技术进展,供全世界同行们利用和进一步完善。于是一时间风起云涌群贤毕至,似乎利用“神话”蛋白-核酸酶技术(TALEN)改造人类基因组的临床实践很快就要发生了。实际上,短短一两年时间内也确实有不少实验室开始探索是否可以利用这种技术用于临床基因治疗。例如在2013年,南非科学家们就发表学术论文称,可以利用TALEN技术在乙肝病毒的DNA上诱发突变,破坏乙肝病毒在人体的复制,以治疗乙型肝炎。不过为了避免不必要的误会,作者要说明这项应用本身,以及TALEN技术其他的应用尝试,仅仅是非常早期的实验室研究,距离真实的临床应用还非常遥远。
然而也就是在这短短一两年时间里,TALEN的风头迅速被另外一种更新的基因组编辑技术盖过而且被越甩越远。站在锌手指蛋白肩头、开启基因组编程时代的“神话”,迅速也成为科学史上一级窄窄的阶梯,任由科学家们接踵摩肩而过,走向基因治疗的最前沿。
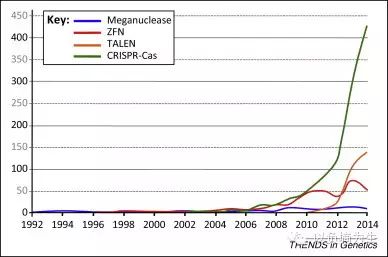
TALEN“神话”的短暂光芒。这幅图展示的是科学文献数据库中,提及几种不同的基因组编辑技术的频率随时间变化的趋势。红色-锌手指蛋白(ZFN)的概念自1996年首次出现,之后一直不温不火,最高峰时期每年不过数十篇学术论文提及它,一个重要的原因可能是Sangamo公司围绕锌手指蛋白组装技术的专利壁垒。黄色-“神话”蛋白(TALEN)自2011年出现后其热度呈指数上升,2012年就已经超过了其前辈锌手指蛋白。然而更吸引眼球的是绿线,这种名为CRISPR-Cas的新型基因组编辑技术正式诞生于2012年,之后便迅速成为基因组编辑技术的代名词,完全掩盖了其他两种先辈技术的光芒。(图片来自Guy-Franck Richard Trends in Genetics 2015)
那么在“神话”降世之后的那一两年里,发生了什么惊天动地的大事情呢?
CRISPR:细菌生命的礼赞
这次硬要出头抢去了“神话”风头的是基因组编辑领域的小兄弟,有个长的可以吓跑一半读者的学术大名叫“成簇规律间隔短回文重复序列”(Clustered Regularly Interspaced Short Palindromic Repeats)。不过读者们别怕,这么佶屈聱牙的名字,全世界的正常和文艺科学家也都记不住,大家于是总是用这个名字首字母的组合“CRISPR”来称呼这种新技术。CRISPR的发音和一个英文单词“冷藏保鲜盒”(crisper,就是冰箱里面专门放瓜果蔬菜的那个透明抽拉盒)一样,而新鲜出炉的CRISPR技术也真的像这个发音暗示的那样,鲜活水灵,一个猛子扎到基因组编辑的领地里,成功的扮演了整个基因治疗领域搅局者的角色。
要说起CRISPR技术的由来,甚至比锌手指蛋白和“神话”蛋白还要更天外飞仙一点。
一路追故事到现在的读者们可能已经意识到,同样用于基因组定位的锌手指蛋白和“神话”蛋白虽然来源和机理并不相同,但是它们工作的逻辑却是很接近的。两者本身的生物学功能,都是定位基因组上的特定基因序列。锌手指蛋白最早发现于非洲爪蟾的细胞,它们被用来定位基因组序列并启动特定基因的转录和蛋白质合成;而“神话”蛋白来自一类特殊的植物细菌—黄单胞菌,其功能也是被用来定位基因组序列—只不过这回是被细菌用来偷梁换柱的启动它所寄居的植物细胞的基因转录。
在上回书“黄金手指”的讨论中,我们已经说过对于几乎所有的有机生命来说,利用某种工具来精细的调节遗传信息的“利用度”,决定在何时、何地、哪种场合下开启或关闭哪些基因,都是对生存繁衍至关重要的能力。因此毫不奇怪大自然一万年的进化产生了像锌手指蛋白和“神话”蛋白这样具备高超的基因组定位能力的物质。同样,这大自然的馈赠被万物之灵的人类加以利用,用于精确修正人类自身的遗传信息,不管经历了多少曲折和反复,终究也是合乎逻辑的事情,是不是?
但是CRISPR的缘起可就与此毫不搭界了。这个新鲜的小家伙当然同样是亿万年进化的产物,不过它原本的功能可不是用来精密调节基因组的开关,而是——细菌的免疫系统。
什么?细菌也有免疫系统?话说我们人类的免疫系统不就是用来对付这些讨厌的小虫子的么?怎么这些小虫子自己也有所谓的免疫系统?
你没听错。本身就是高等生物免疫系统绞杀对象的细菌,自身也有需要对付的寄生生物——病毒。而这类专门欺负细菌的病毒,我们管它们叫噬菌体(bacteriophage,或者简称phage)。
要说这背后的逻辑并不奇怪,我们在基因治疗系列的一开头讲过一点点病毒的故事。病毒作为地球上最简单的有机生命形式,没有独立生存繁衍的能力,它们必须选择一种更复杂的有机生命作为宿主,通过入侵宿主细胞、利用宿主细胞的资源复制自身再开枝散叶,才能够完成生命繁衍的循环。在漫长的进化史上,有些病毒选择了入侵动物(比如说我们刚刚提到的乙肝病毒),有的选择了入侵植物(比如烟草花叶病毒,这是世界上第一种被发现的病毒),而有的选择了入侵细菌。别看细菌个头小,它们还是要比病毒大上数百倍,足够噬菌体们藏身和繁殖了,而且我们的地球上细菌的数量可能是所有“高等”生命的亿万倍,光一个人口腔里的细菌数目就超过全世界的人口总数,因此噬菌体们也不愁找不到可以安身立命的寄居地。
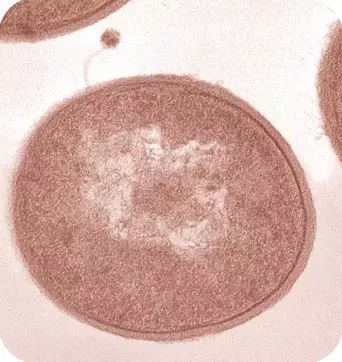
在电子显微镜下,可以清晰的看到一个噬菌体病毒(上方的带着细细”针头“的小颗粒)正在入侵一个细菌(图片来自Marx Science 2007)。
而对于被青睐的细菌而言,噬菌体们可就是不折不扣的麻烦制造者了,就像我们人类讨厌各种各样给我们带来疾病的细菌一样。没有办法像高等生物一样专门开发出一套免疫系统来对付入侵者,小小的细菌也有自己的不二法门。
这个法门就是CRISPR。
从CRISPR的全名“成簇规律间隔短回文重复序列”上读者们也可以大致猜测出,CRISPR本身其实就是基因组DNA上的一段特殊的序列,这段序列倒是很有个性:几十个碱基构成的特殊DNA序列连续串联重复多次,在重复单元之间的间隔也差不多有几十个碱基那么长,但是这些间隔序列的构成却是千变万化毫无规律可循。当上个世纪八十年代末,日本科学家在几种细菌的基因组上发现这么一长串很有个性的序列时也着实被迷惑了,只好老老实实的在论文里描述了一下它的样子就束之高阁了。这一迷惑,居然就迷惑了差不多二十年。在此期间世界各地的科学家陆续在不同的细菌中发现了类似的CRISPR序列,但是始终不清楚这种序列到底意味着什么。
这张卡通图描述了一段典型的CRISPR序列的模样。用数字标记的浅蓝色线段代表了串联重复的DNA序列,而深蓝色的线段则是千变万化的非重复序列。在之后的研究中,科学家们逐渐发现许许多多细菌中都有类似结构的CRISPR序列。(图片来自Makarova et al Nature Rev. Microbiol. 2011)
直到二十世纪初,随着大规模基因组测序技术的成熟和生物信息学的兴起,人们逐渐积累了大量细菌物种的完整的、从头到尾的基因组DNA序列信息。这时候科学家们已经可以不必费心费力的在实验室一种一种细菌的筛查基因组DNA序列,只需要在电脑前写几行程序代码,就可以分析成百上千种不同细菌中是否存在相似的序列了。于是这时候又有记性比较好的科学家,回头想起了这种困惑大家二十年的、很有性格的序列。
不比不知道,一比吓一跳。在2000年就有几位这样记性很好的西班牙科学家查看了下当时已经具有完整基因组信息的许多种细菌,居然看到二十来种细菌和古细菌(古细菌是一种相比细菌更加原始的单细胞生物)里,都带有结构组成相当类似的CRISPR序列!这就有意思了,要知道对于任何有机生命来说,小心翼翼的保存、复制和传递遗传物质信息都是件很困难、也很浪费资源的事情。在自然选择的作用下,很难想象会有这么多不同的物种会不约而同的保留这么长长一串一点功能也没有的DNA序列。因此,一个直觉的猜测就是,CRISPR序列应该是有生物学功能的,而且很可能是对细菌来说至关重要的功能。
于是这帮好记性的西班牙科学家再接再厉。到2005年,他们继续搜集了六十多种细菌中多达四千五百段CRISPR序列(严格来说,是CRISPR中花样较多的”间隔“序列的信息),发现其中有88段居然在不同物种中重复出现。更妙的是,这其中还有相当部分(47个)的序列,恰好还和许多当时已知的噬菌体基因组序列信息高度一致!打个不那么恰当的比方,就像细菌深处,不知道为什么偷偷隐藏了不少噬菌体病毒的高清自拍照!
这太好玩了,细菌对噬菌体避之唯恐不及,怎么可能还小心翼翼收藏它们的自拍?
生物学家们一般情况下不会有这种过度浪漫的情怀。他们的第一反应很简单:既然细菌讨厌噬菌体,却又费心费力的在基因组里留下各种噬菌体的序列信息,那么大概应该也许可能是用来对付噬菌体入侵的武器吧!这个逻辑也很容易验证:如果真的是这样,那么拥有噬菌体自拍的细菌应该不容易被病毒入侵,反而那些没有噬菌体自拍的细菌就成了病毒理想的栖息地。这个假设很快在计算机上被验证。而很快在2007年,一群在鼎鼎大名的杜邦公司旗下的丹尼斯克食品配料公司工作的科学家,在嗜热链球菌中,严格证明了CRISPR序列对于细菌免疫系统的功能:他们证明,在这种细菌中人工添加一段CRISPR序列,就可以像给细菌打了疫苗一样,可以帮助细菌抵挡某种对应病毒的入侵!这群科学家同时也证明,细菌的免疫系统还有自我进化的高级功能,每当有新的噬菌体病毒入侵,细菌就可以把它的基因组序列整合到自己的CRISPR序列中,这样下次同样的病毒入侵细菌就可以正确识别和对抗它们了。
嗜热链球菌(Streptococcus thermophulus),现代酸奶工业的基石之一。而这种细菌的存活受到多种噬菌体入侵的威胁。笔者不揣冒昧的想象,也许正是为了解决由于噬菌体入侵导致的酸奶生产问题,丹尼斯克(Danisco)的科学家们证明了CRISPR的免疫力。(图片来自www.emaze.com)
好了,这个发现应该足够惊悚了。原来以为只有像人类这样的高等生物才有的免疫系统,原来只有一个细胞、几十微米大小的细菌居然也有,而且还居然具备自我进化、迅速适应和对抗新病毒入侵的能力。从任何角度出发,这都是项足以载入史册的重大发现。这个发现自身就无比优雅和简练的说明了有机生命的伟大生命力。小小的细菌,没有多余的空间和资源来负担复杂的免疫系统对抗入侵者,仅仅用自身基因组序列上的一小段重复DNA片段,就能够抵挡病毒的侵袭。这种能力应该让至今仍被流感病毒所困的人类自愧不如吧!
读者们可能要问了,这个发现确实很有趣、很重要。但是你怎么讲着讲着基因组编辑和基因治疗,突然开始扯细菌的免疫系统了?满嘴跑火车笔下骗稿费说的就是你吧?
别急别急。讲完了CRISPR的由来,我却专门有意略过了CRISPR对抗病毒的机制。读者们不妨关上手机屏幕想上几分钟:一段不会跑也不会跳的DNA序列,怎么能识别并抵挡病毒入侵呢?
CRISPR的这种神奇的能力,很快被发现和了解。而也正是这种能力,构成了一种热热闹闹的基因组编辑技术的基石。
超轻量级基因组GPS
其实发现细菌CRISPR序列和噬菌体基因组序列高度一致之后,科学家们在第一时间就很敏锐的意识到,也许CRISPR序列的目的正是定位入侵的病毒。注意这里的关键词:定位!
我们知道,病毒颗粒是不具备独立完成生命生存繁衍整个循环的能力的。病毒的“生命力”本身,就依赖于病毒颗粒首先进入宿主细胞中,释放出自身的遗传物质,并且利用宿主细胞的资源帮助其复制扩增其遗传物质。换句话说,病毒进入细胞的第一件事就是迫不及待的把自己的遗传物质给暴露出来,这是它生存繁衍的第一要务。而细菌是不是也可以利用这一点来实现对病毒的精确打击?比如说,细菌基因组上的CRISPR序列,是不是就是为了提供一个互补的“地图”,让细菌知道什么时候有病毒基因组进入细胞了?
这个可能性迅速得到了验证。科学家们发现,细菌的CRISPR序列在正常情况下是可以被转录成RNA分子、游离于细胞当中的。这些小段CRISPR RNA分子能够充当向导的角色,带着一个名为Cas9的核酸酶蛋白(功能类似于我们讲过的FokI蛋白),在细胞体内终日游荡。而当某时某地某个情况,病毒入侵、病毒DNA充斥细胞时,带着向导的Cas9就有用武之地了。一旦它发现某个病毒DNA的序列,和自身向导的序列完全一致,Cas9就可以大发神威,把病毒DNA咔嚓一刀断了根。一刀两断的病毒当然就失去了鼠窃狗偷、继续利用细菌的资源生存繁衍的能力了。我们一句话总结就是,细菌的免疫系统其实就两个几段简化的组件,CRISPR RNA的功能类似于锌手指蛋白和“神话”蛋白,用来精确定位病毒的入侵;而Cas9蛋白的功能则类似于FokI核酸酶,专门剪断已经被识别的病毒。
小小细菌的本事当真让人叹为观止。要知道为了实现对基因组序列的精确识别,高等生物进化出了花样繁多、结构复杂的锌手指蛋白。其中,很天然锌手指蛋白自身的基因长度就超过了细菌的整个基因组大小(几千到上万个DNA碱基)。而小小细菌,用一段几十个DNA碱基的CRISPR序列,就把基因组定位的功能解决了。CRISPR,堪称超轻量级的基因组GPS。
而这一次人们对CRISPR的研究恰逢其时。别忘了,二十一世纪初正是几种基因组编辑技术方兴未艾,传统的基因治疗技术捷报频传的时候。CRISPR序列和Ca9蛋白的双簧理所当然的吸引了孜孜以求高效编辑基因组技术的科学家的注意。
2005年,就在那群好记性的西班牙科学家在许多细菌中发现了CRISPR序列的时候,美国加州大学伯克利分校的结构生物学家珍妮弗.道德纳(Jennifer Doudna)偶然从地球微生物学系的同事吉莉安.班服尓德(Jillian Banfield)那里听说了CRISPR。某天在校内的“言论自由运动”咖啡馆小坐闲聊时,班服尓德告诉道德纳,她的实验室从附近的铁矿中发现的许多细菌,也带有这种神奇的CRISPR序列。
加州大学伯克利分校(University of California, Berkeley)著名的“言论自由运动”咖啡馆。加州大学伯克利分校素来是美国校园政治运动的急先锋,在上世纪六十年代的“言论自由运动”(Free Speech Movement)更是成为美国民权运动的标志之一。笔者当年在这里工作时,几乎每天都要到这里来买咖啡:) (图片来自www.bridgeandtunnelclub.com)
和一心想着解决细菌免疫问题的细菌学家们不同,道德纳是早已功成名就的结构生物学家,长期利用X射线衍射的方法了解蛋白质大分子的三维结构。她尤其对和RNA分子相关的蛋白质结构感兴趣。因此当几年后道德纳意识到CRISPR RNA能够指导Cas9蛋白发现病毒入侵者时,她意识到现在轮到自己上战场了。
道德纳原本的目标其实顺理成章。她希望利用自己的看家本领,在单个原子的尺度上,看清楚CRISPR RNA究竟如何帮助Cas9蛋白实现病毒基因组的精确定位。
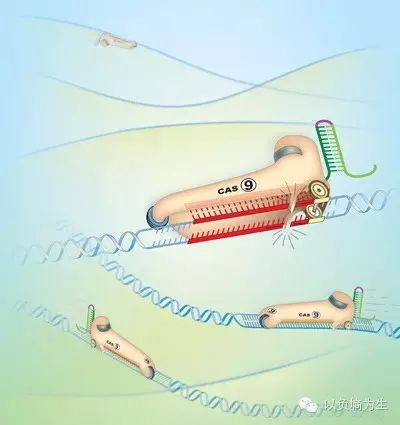
CRISPR/Cas9系统的工作原理。在这张显然是过度简化的卡通图里,Cas9蛋白(带着滑轮和剪刀的溜冰鞋)在CRISPR RNA(冰鞋后面绿色的线段)的指导下在基因组(蓝色的双螺旋)上逡巡定位,一旦CRISPR发现一致的序列,Cas9蛋白就停下来挥动剪刀。(图片来源:www.berkeley.edu)。
道德纳的目标并不令人意外的实现了。我们现在知道,Cas9蛋白是如何在CRISPR的指引下精确定位基因组,随后剪切破坏目标DNA的。道德纳和同事们的工作,从原子水平完美的解释了细菌免疫系统、特别是CRISPR这个超轻量级基因组GPS的工作原理。
然而和我们故事更相关的,其实倒是道德纳和同事们漫漫探索道路上的一个副产品。
请期待下一回合:基因治疗的前世今生(九):编程时代(下)。CRISPR/Cas9系统,大举杀入基因治疗领域。