基因敲入鼠的的原理、构建、鉴定与应用
导语 上期我们讲解了基因敲除鼠(KO)的构建,虽然基因敲除鼠是最常用的转基因鼠,但依然有一些问题比如研究需引入外源基因或是点突变基因,却是这种模型不能解决的。由此,基因敲入鼠(KI)应运而生。本期就为大家讲解一下基因敲入鼠的的原理、构建、鉴定与应用等。
基因敲入的原理
基因敲入是基于基因重组原理,将外源基因插入生命体基因组中,并使其在体内表达的技术。基因敲入一般有两种形式:
① 定点敲入:通过插入特定启动子位点来表达外源基因
在小鼠基因组的安全位点插入一段表达蛋白质所需要的完整DNA序列单元:包含特定启动子,需要过表达基因的CDS区以及polyA结构来实现过表达某种蛋白质。该位点一般能保证插入基因的正常表达,且对小鼠也无副作用。例如ROSA26位点就是一个非常成熟的位点,引物、同源臂的设计都得到验证。
② 原位敲入:在原基因敲除的位点插入新的基因
利用小鼠自身的启动子,在原基因敲除的位点插入新的基因CDS区,一般为引入报告基因以观察启动子表达情况,如GFP。也用于点突变鼠的构建。
下面我们分别介绍一下两种基因敲入鼠的设计和构建
(一)ROSA26位点定敲入鼠的构建
关于ROSA26位点
ROSA26位点位于小鼠基因组第6号染色体上,表达四个非编码的转录本。研究证实,这个位点的基因敲入对细胞及小鼠的健康无副作用,并能保证转入基因的正常稳定表达。该位点的两个等位区都带有外源插入片段的纯合子小鼠幼崽出生率略低于杂合子幼崽,但是也能正常发育并繁殖。结构图如下所示:

定点敲入的设计与构建
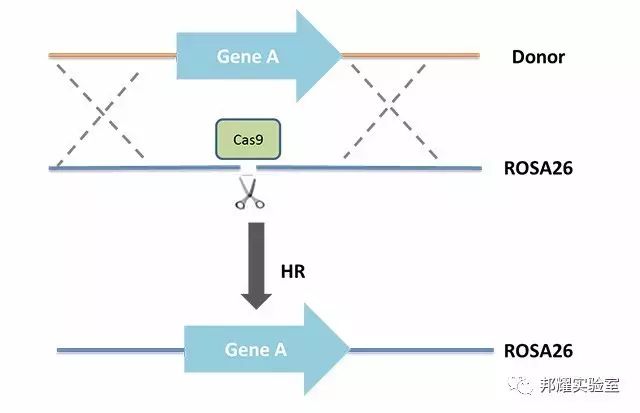
①首先需要一种基因编辑技术将ROSA26位点切开,方便该位点进行同源重组,如CRISPR/Cas9技术。由此,需要设计剪切ROSA26位点的CRISPR/Cas9系统向导RNA;
②另一方面,设计插入基因A,并在基因A两侧设计ROAS26位点的同源臂;
③将该同源重组供体(Donor)与CRISPR/Cas9相关RNA一同注射入小鼠受精卵中,利用CRISPR/Cas9在ROSA26位点形成DNA双链断裂,再利用同源重组将外源基因整合入ROSA26位点。
基因敲入小鼠的其余构建过程与基因敲除类似(基因敲除小鼠链接),经过gRNA设计和筛选,sgRNA表达载体构建,显微注射,胚胎移植,小鼠培育及繁殖及小鼠基因型鉴定等过程。不同的是,需要额外设计插入片段,即整合入ROSA26位点的片段。
(二)点突变的原位点敲入鼠构建
基于基因敲入技术的点突变鼠是也通过类似基因敲除的手段切割该段基因,随后利用同源重组原理,将经过点突变的片段整合入原基因组位点来构建的。若以CRISPR/Cas9基因编辑技术切割基因,需要设计该段基因的CRISPR/Cas9剪切向导RNA,以及经过点突变的基因片段,用以整合入基因组。随后将这些片段通过显微注射的方式打入小鼠受精卵,等待胚胎发育,经过鉴定幼崽即可得到想要的点突变鼠。
(三)基因敲入鼠的鉴定、繁殖与应用
1. 基因敲入的鉴定
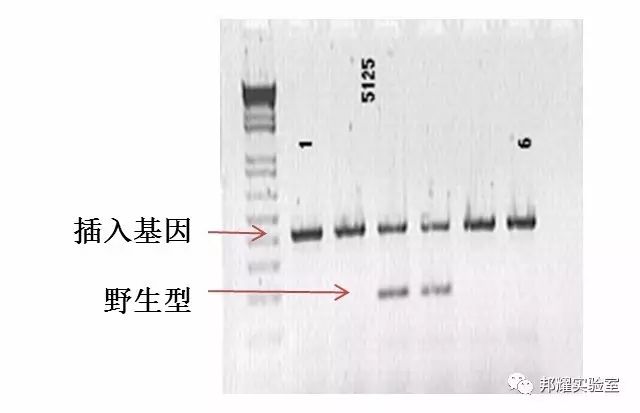
胚胎移植后的小鼠约在19天后出生,取子代小鼠的基因组DNA进行基因型鉴定,一般使用PCR的方法,通过引物扩增外源片段。
引物设计:一般设计ROSA26位点上下游的引物进行PCR;若要精细地确定插入位置,则需设计三对引物:插入的同源臂前段、插入的同源臂后段、目的片段,用于检测插入片段前端、后端、以及目的基因序列正确与否。若需要更精确的检测,可以进行小鼠基因组测序。
图3. ROSA26 位点PCR结果示意图
2. 小鼠交配方案设计
与KO鼠相似的,通过对出生的小鼠进行鉴定,一般可以获得F0代基因突变鼠。待F0代小鼠性成熟后将其与具有相同突变类型的小鼠进行交配,可获得具有稳定突变的F1代纯合小鼠。运用下图所示交配方案获得纯合子基因敲入鼠后,令鉴定为纯合子的敲入鼠与另一批敲入纯合鼠交配,获得稳定遗传的后代。
图4. 杂合子小鼠通过基因分离获得纯合子小鼠的交配方案
3. 小鼠使用方案设计
与基因敲除鼠类似,后续小鼠实验分组一般分为实验组(基因敲入鼠)与对照组(野生型),小鼠只数为4~6只。例如,发表于2014年的一项研究中,研究人员就使用了4~6只的小鼠用于分子检测,使用了24组数据用于批量数据比对。[1]
4. 基因敲入小鼠的后续应用
基因敲入鼠可应用于多种研究中,包括且不限于以下几种:
① 多用于构建人源化动物疾病模型;过表达人源基因,模拟人源基因过表达疾病,比如对阿兹海默症的研究就依赖于对APP小鼠(例如,Tg2576-APPswe mice)的运用;[2]
②构建细胞特异表达的Cre鼠,利用启动子的表达特异性,将Cre基因插入启动子之后即可得到特异表达的Cre鼠。例如GFAP-Cre鼠,即是在GFAP启动子后插入Cre基因,在星形胶质细胞表达Cre基因;
③研究外源基因的功能,基因敲入可以用于研究非鼠源的(比如人源)基因的功能;
④研究点突变对基因功能的影响;
⑤引入报告基因,如GFP,观察启动子的表达情况。
作为协助及提供科研解决方案的生命科学实验室,邦耀实验室基于基因编辑技术平台,已经成熟掌握利用CRISPR/Cas9技术进行基因敲入大小鼠,获得Founder(F0代小鼠)仅需4月,获得稳定遗传的F1代最快仅需6个月,可以高效靶向地为您提供优质的模式动物技术服务。
参考文献:
[1].Alves S, Cormier-Dequaire F, Marinello M, Marais T, Muriel M-P, Beaumatin F, et al. The autophagy/lysosome pathway is impaired in SCA7 patients and SCA7 knock-in mice. Acta Neuropathologica. 2014;128(5):705-22.
[2].X Yang CY. A novel mechanism of memory loss in Alzheimer's disease mice via the degeneration of entorhinal -CA1 synapese. Nature. 2016.