肿瘤治疗策略:通过基因调控IP3R3和Ca2+介导的细胞凋亡,抑制肿瘤生长
6月13日,《Nature》同期在线发布了夏威夷大学癌症中心揭示的BAP1的细胞质活性及纽约大学医学院确定的PTEN作为肿瘤抑制因子的磷酸酶依赖性机制,即均可结合并调节IP3R3介导Ca2+释放,促进细胞凋亡,抑制细胞转化,从而限制肿瘤生长。具体研究结果,下面小编带大家一起来看看吧~~~
一、BAP1的细胞质活性——调节IP3R3介导Ca2+释放促进凋亡,抑制转化

摘 要
BRCA1相关蛋白1(BAP1)是调节环境致癌作用的有效肿瘤抑制基因。遗传杂合种系BAP1失活突变(BAP1+/-)的所有携带者会发展出多种BAP1-/-恶性肿瘤。此外,BAP1获得性双重突变在人类癌症中频繁发生。定位于核中的BAP1具有肿瘤抑制因子活性。但是BAP1在细胞质中的活性仍是未知的。本研究发现BAP1定位于内质网。并结合,去泛素化和稳定3型肌醇-1,4,5-三磷酸受体(IP3R3),调节从内质网到胞液和线粒体的Ca2+释放,促进细胞凋亡。BAP1+/-携带者中降低BAP1的水平导致IP3R3水平和Ca2+通量降低,从而阻止BAP1+/-细胞累积DNA损伤的细胞凋亡。因此,BAP1+/-携带者中癌症发生率高是由于核和细胞质中BAP1活性的降低。本研究为BAP1在人类致癌过程中调控基因-环境相互作用的强大能力提供了机制理论依据。
研究结果

BAP1的抗凋亡作用及其定位



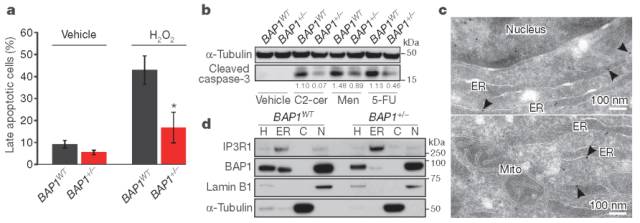
图1
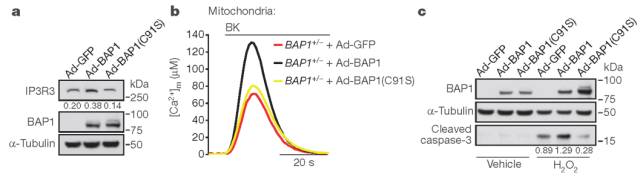
BAP1+/-成纤维细胞比匹配的BAP1WT成纤维细胞更能抵抗各种凋亡药物(图1a,b)。细胞核外的BAP1特异性地存在于内质网(图1c);BAP1+/-成纤维细胞中,内质网(ER)的BAP1水平低于核中的水平(图1d)。

细胞质BAP1参与调控细胞内Ca2 +



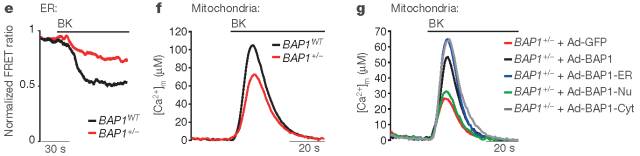
图2
与BAP1WT相比,BAP1+/-成纤维细胞通过IP3Rs减少ER中Ca2+释放量(图2e);与缓激肽刺激的BAP1WT成纤维细胞相比,细胞溶质和BAP1+/-的线粒体基质中Ca2+浓度较低(图2f)。BAP1-Nu、BAP1-Cyt和BAP1-ER腺病毒嵌合体中,只有细胞质和ER的嵌合体可调控Ca2+的变化(图2g)。表明细胞质BAP1独立于核BAP1调节Ca2+。

BAP1去泛素化并稳定IP3R3



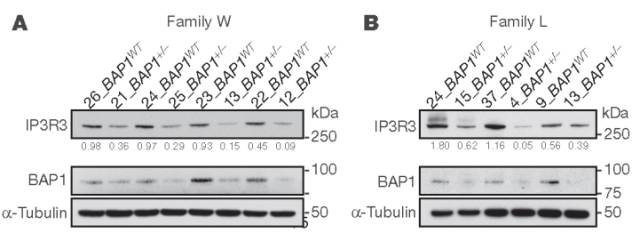
图3
IP3Rs可快速泛素化并被蛋白酶体降解。与BAP1WT相比,来自BAP1+/-供体的成纤维细胞中IP3R3蛋白水平降低(图3A,B)。


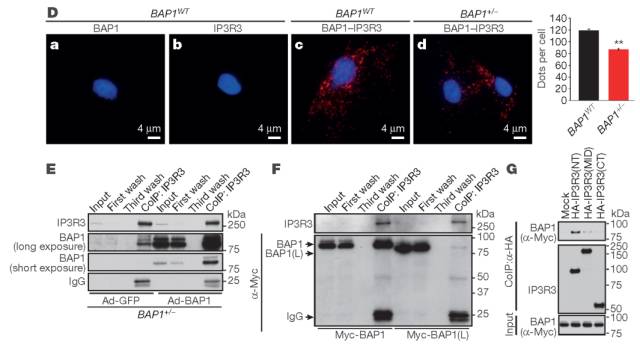
图4
研究发现IP3R3可免疫共沉淀BAP1(图4D)。BAP1+/-成纤维细胞中,BAP1的挽救实验显著增加了与IP3R3免疫共沉淀的BAP1的量(图4E)。并且BAP1结合于IP3R3的N末端结构域(图4G)。

BAP1与IP3R3结合介导Ca2+转移



图5
BAP1WT成纤维细胞中BAP1的沉默导致IP3R3蛋白水平的降低,伴随着线粒体Ca2+反应的降低和凋亡的保护作用。同样地,BAP1WT成纤维细胞中,IP3R3的沉默会导致线粒体Ca2+浓度降低和细胞凋亡。BAP1可抵消IP3R3(NT)的泛素化。
用编码BAP1的腺病毒转导BAP1+/-成纤维细胞,挽救了IP3R3蛋白水平和线粒体Ca2+摄取(图5a,b),增强了细胞凋亡(图5c)。

电离或紫外线辐射,青石棉对细胞转化的影响



图6
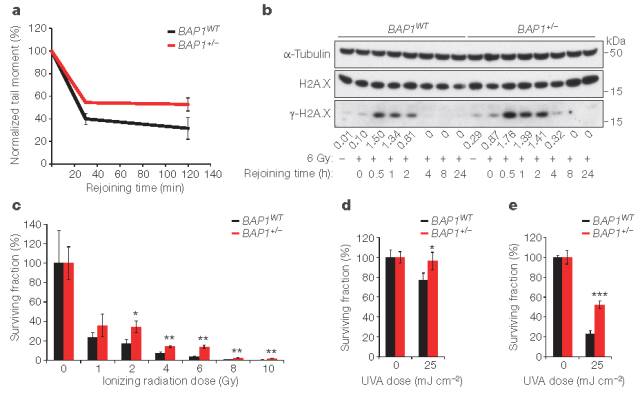
彗星测定显示,BAP1+/-成纤维细胞在暴露于电离辐射后具有降低DNA损伤修复能力(图6a);但克隆形成测定显示电离辐射后BAP1+/-细胞存活率增高(图6c)。暴露于UVA或UVB条件下,显示BAP1+/-成纤维细胞中集落形成的可重现性显著增加(图6d,e)。
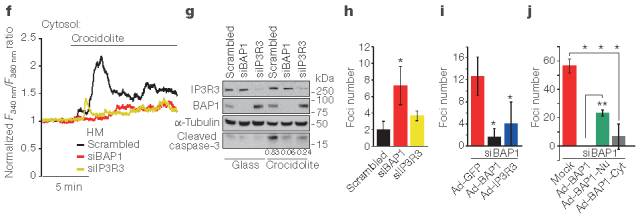
此外,暴露于青石棉可使细胞内Ca2+浓度减少及抗细胞凋亡(图7f,g)。siBAP1处理并暴露于青石棉使病灶形成显著增加(图7h)。若转导BAP1或IP3R3则显著减少病灶形成(图7i)。

细胞质与核中BAP1对细胞转化的作用



图7
为了测试细胞质和核BAP1对细胞转化的独立作用。沉默BAP1并用BAP1嵌合体感染人间皮细胞。特异性定位于细胞质的BAP1-Cyt的转导显著减少集落形成至与使用BAP1获得的水平相似;感染BAP1-Nu的细胞仅局限于细胞核,表现出集落形成的减少,尽管其减少明显少于用BAP1感染的细胞(图7j)。
主要技术
基因沉默与siRNA;细胞增殖/凋亡检测(流式分析);亚细胞分离;免疫荧光;免疫电镜术;免疫共沉淀;体外泛素化和去泛素化分析;体外细胞转化实验等。
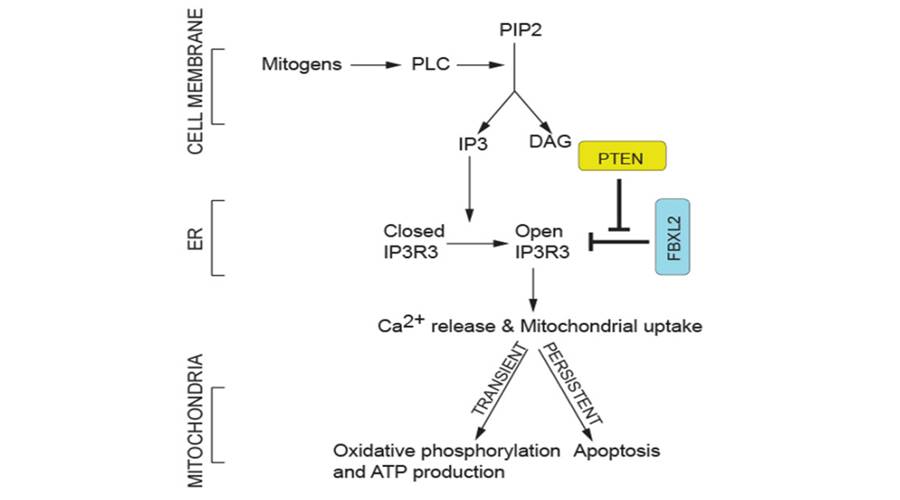
二、PTEN可阻碍FBXL2来促进IP3R3和Ca2+介导的细胞凋亡从而限制肿瘤生长

主要研究结果
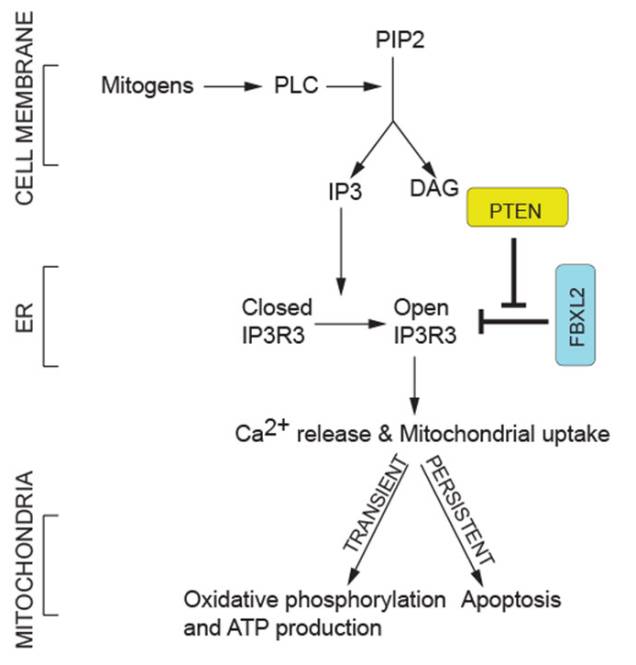
纽约大学医学院研究发现F-box蛋白FBXL2(含有一个C-末端CaaX结构域)可结合IP3R3,野生型FBXL2的表达可诱导IP3R3水平的降低以限制Ca2+流入线粒体;将FBXL2 knockdown会增加胞质Ca2+的释放及Ca2+依赖性凋亡刺激的敏化作用。
PTEN可与FBXL2竞争结合IP3R3。Pten-/-小鼠胚胎成纤维细胞和PTEN-无效癌细胞中加速了FBXL2对IP3R3的降解;而野生型PTEN或catalytically dead mutant重建PTEN-无效细胞可稳定IP3R3并诱导持续的Ca2+转移和细胞凋亡。
细胞培养和异种移植模型中,IP3R3不降解突变体使得无PTEN表达的肿瘤细胞对光动力治疗(PDT)敏感,由于光敏药物在用可见光照射后可引起Ca2+依赖性细胞毒性。类似地,GGTi-2418(牛儿基牛儿醇转移酶抑制)对FBXL2定位的破坏使异种移植的肿瘤对光动力治疗敏感。
该研究确定了一种限制线粒体Ca2+过载以预防细胞死亡的新型分子机制。值得注意的是,PTEN失调的癌症可抑制IP3R3降解,被证明是一种有效的治疗策略。


主要技术
细胞转染、siRNA基因沉默、细胞凋亡检测、CRISPR基因组编辑、活细胞成像、免疫组化等
锐博生物拥有人大小鼠源基因组所有基因siRNA(其他物种亦可定制)、EdU细胞增殖/凋亡检测试剂盒等细胞或动物实验产品,可为广大科研人员进行基因体内功能研究提供使用便捷的产品。
原文:
Bononi A, Giorgi C, Patergnani S, et al. BAP1 regulates IP3R3-mediated Ca2+ flux to mitochondria suppressing cell transformation[J]. Nature, 2017.
Kuchay S, Giorgi C, Simoneschi D, et al. PTEN counteracts FBXL2 to promote IP3R3-and Ca2+-mediated apoptosis limiting tumour growth[J]. Nature, 2017.