FDA肿瘤药物专家咨询委员会支持批准治疗白血病的CAR-T基因疗法上市
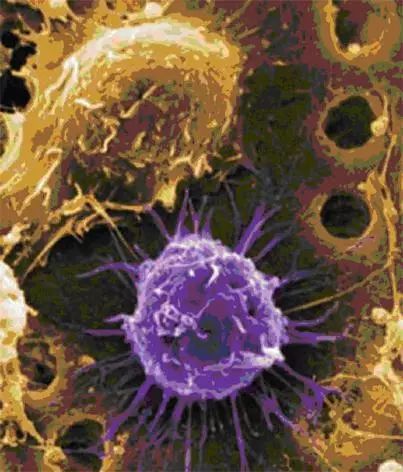
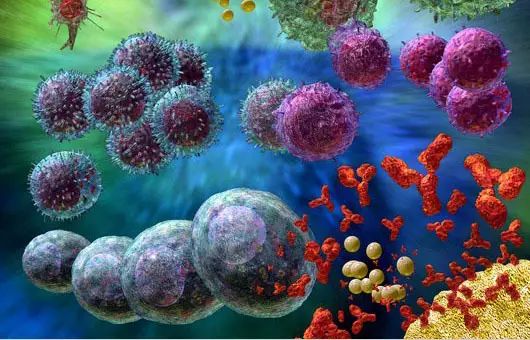
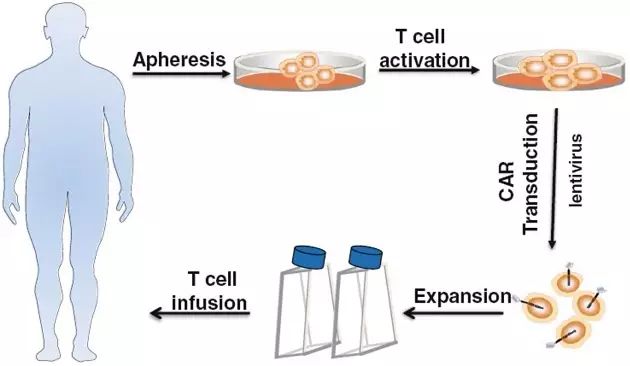
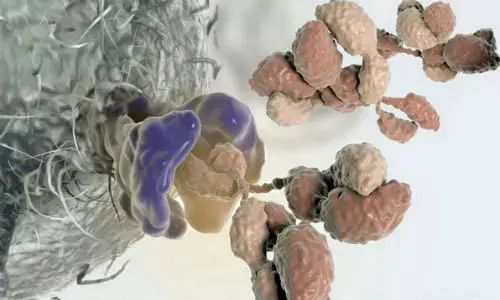
12 重大消息 就在本周三(7月12日),美国食品药物管理局(FDA)肿瘤药物专家咨询委员会(ODAC)以10:0的投票结果一致支持批准治疗白血病的CAR-T基因疗法Tisagenlecleucel (CTL-019)上市。该疗法主要运用于治疗3-25岁复发或难治性急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL)患者,由宾夕法尼亚大学和诺华公司(Novartis Corp)合作研发。 什么是急性淋巴细胞白血病(ALL) 急性淋巴细胞白血病(ALL)是一种起源于淋巴细胞的B系或T系细胞在骨髓内异常增生的恶性肿瘤性疾病。异常增生的原始细胞可在骨髓聚集并抑制正常造血功能,同时也可侵及骨髓外的组织,如脑膜、淋巴结、性腺、肝等。我国曾进行过白血病发病情况调查,ALL发病率约为0.67/10万。 根据美国疾病控制和预防中心的数据,2014年有近5000人被诊断患有急性淋巴细胞白血病。有超过一半患者为儿童和青少年。 绝大多数患者都通过其他的治疗方法,包括化疗、放疗和干细胞移植,取得一定的效果。但如果癌症复发,预后可能会很糟糕。 宾夕法尼亚儿童医院癌症免疫疗法项目主任Stephan Grupp周三在FDA顾问委员会的会议上说:“当化疗不起作用时,那些‘被遗弃’的病人将会非常艰难。”他是宾夕法尼亚儿童医院癌症免疫疗法的主任。他的医院是参与该研究的26个临床中心之一,他是那里的首席研究员。因此,他已经研究并治疗了患有该疾病的病人超过5年,并获得诺华公司的研究支持。 CTL-019又是何方神圣 Tisagenlecleucel(CTL-019)是一种称为嵌合抗原受体T细胞疗法(Chimeric antigen receptor T-cell therapy,CAR-T)的免疫疗法。 像CTL-019这样的CAR-T是通过从病人身上分离自身免疫细胞来制造的,通过基因修饰技术对它们进行基因改造,体外扩增后再把它们回输病人体内。通过基因修饰技术,改造后的T细胞表面表达识别癌细胞特异性蛋白的针对性受体,这样,CAR-T细胞进入病人体内后,能够快速、精确的识别和杀伤癌细胞。 然而这种治疗存在一定的风险 1、通过病毒的方式改造细胞会将外源DNA插入T细胞内,改变了细胞内原DNA序列,这种方法在理论上可以导致其他癌症——这是基因治疗多年一直被关注的话题。但是研究人员还没有在CAR-T治疗中发现肿瘤的形成。然而,这可能还需要几十年的时间来确定这不会发生。 2、这种药物有可能致命的副作用,比如细胞因子释放综合症(Cytokine release syndrome,CRS),它“看起来像败血症”,导致血压下降到危险的低水平。 在这次提交报告中,有68名接受该药物治疗的患者中,有大约一半的人经历了严重的CRS,但没有人死于这种疾病。 3、根据委员会的简报文件,CAR-T有轻微的神经副作用,如癫痫发作和幻觉。 担忧副作用,但不足以妨碍批准 周三的会议上,专家们并没有对该治疗展现的救命潜力提出质疑。但他们对于治疗可能的风险表示担并对于诺华公司在扩大生产规模后,是否能在治疗过程中保持一致性及保证质量提出了担心。 诺华公司则回应称,肿瘤专家们已经掌握如何应对出现严重副作用的方法。关于长期风险至今还没有出现,但这并不能彻底排除可能性,公司承诺将把所有接受治疗的患者登记在册并持续跟踪观察15年。 专家咨询委员会通过评估一致认为,这些潜在风险都不应该妨碍FDA对CAR-T治疗法的批准。加州希望之城国家医疗中心肿瘤专家拉里•夸克称:“我认为这些忧虑中的任何一点都不能阻碍这项迄今为止取得的杰出临床结果。”