转基因 or 基因编辑,原来它们的关系是这样的!
从狭义的严格意义上讲,它们的关系是并列,而非所属
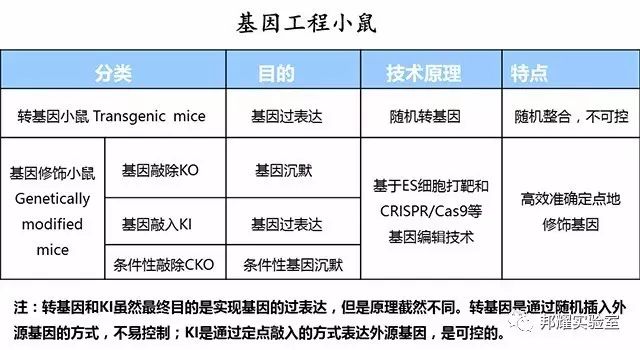
如下表所示:转基因小鼠(Transgenic mice)是一种较早出现的随机转基因的小鼠,单独列出;基因敲除KO,基因敲入KI及条件性基因敲除CKO小鼠等同属于基因定点修饰的小鼠,又名基因编辑小鼠;狭义上讲,2类之间属于并列关系,共称为基因工程小鼠。
为何如此区分?主要在于二者的构建原理:
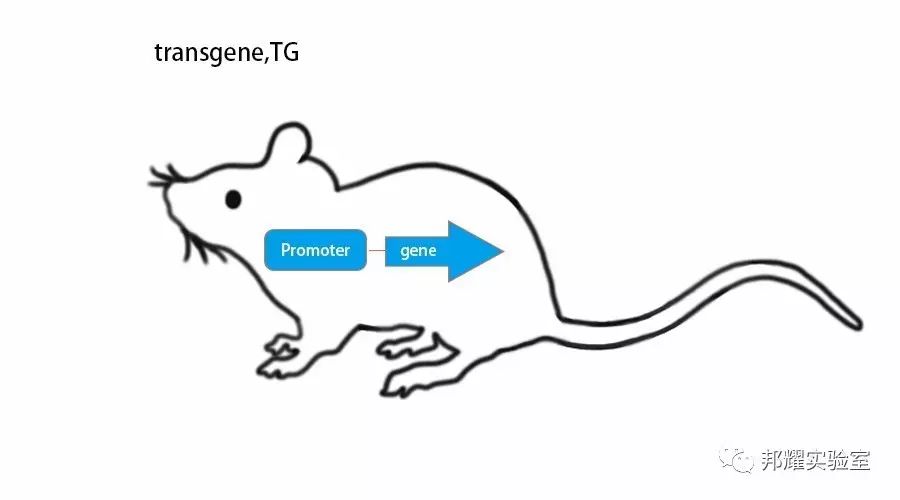
一、转基因小鼠(Transgenic mice)
定义:外源基因随机整合到基因组中,并在体内表达转入基因的小鼠。因为导入的是外源基因,所以被称为转基因(transgene)。
出现时间:1974年,第一只携带外源基因的小鼠(Transgenic mice)的诞生,Gordon等人首次将HSV和SV40 病毒DNA片段的重组质粒,以显微注射的方式导入小鼠受精卵的雄原核内。
1982年: Palmiter等运用此法将大鼠的生长激素rGH基因与小鼠的金属硫蛋白(MT)基因的启动子顺序连接,再引入质粒中。并将这种质粒注入小鼠受精卵中,得到了生长迅速的“超级巨鼠(super mouse)”,当时引起了整个生物学界的轰动。
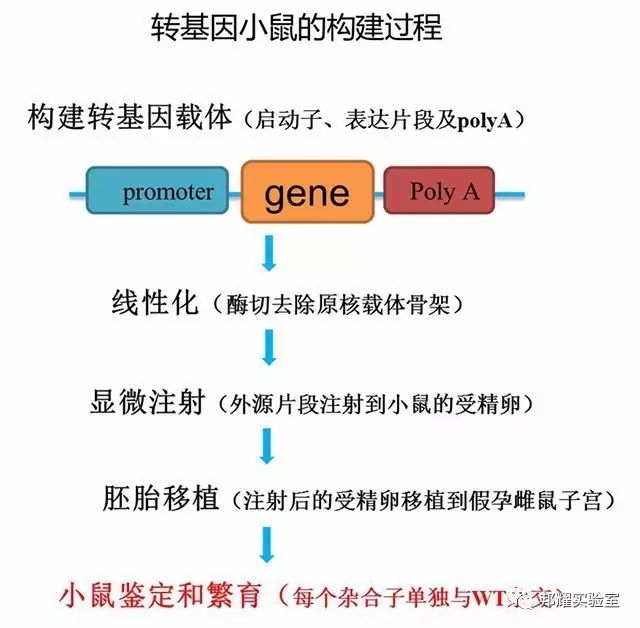
构建方法:主要基于Palmiter等人的技术,通常用显微注射将外源DNA注射(或逆转录病毒介导等方法)入一个受精卵细胞核中,使外源DNA随机整合到小鼠基因组中,进而获得带有外源基因的小鼠。
特点:虽然构建过程简单,但是具体整合的位置是随机的,不可控的。
二、基因定点修饰小鼠
基因定点修饰小鼠定义:通过DNA同源重组(HDR)和非同源末端连接(NHEJ)的DNA修复达到定点修饰基因的目的,包括KO,KI及CKO等类别。
出现时间:1987年,Capecchi和Smithies根据DNA同源重组的原理,首次实现了在小鼠胚胎干细胞(mES)水平上的外源基因的定点整合,这就是广为人知的ES基因打靶技术。
后面随着各种基因编辑技术的发展,构建定点修饰小鼠日益简单,如ZFN(1996),TALENs(2011),近年来热门的CRISPR/Cas9(2013)。
构建方法:传统方法是ES细胞基因打靶技术,基于同源重组对ES细胞特定位点基因进行改造,通过显微注射将遗传修饰的ES细胞引入受体胚胎内。目前应用最多的是最新的CRISPR/Cas9基因编辑技术(操作简便,作用活性高)。
特点:与转基因的最大区别在于并非随机整合,因此可以实现更加高效准确定点的基因修饰。
鉴于前几期我们已经详细介绍ES细胞打靶和基因编辑小鼠的构建方法,这次我们就把转基因小鼠的构建方法做简单介绍。
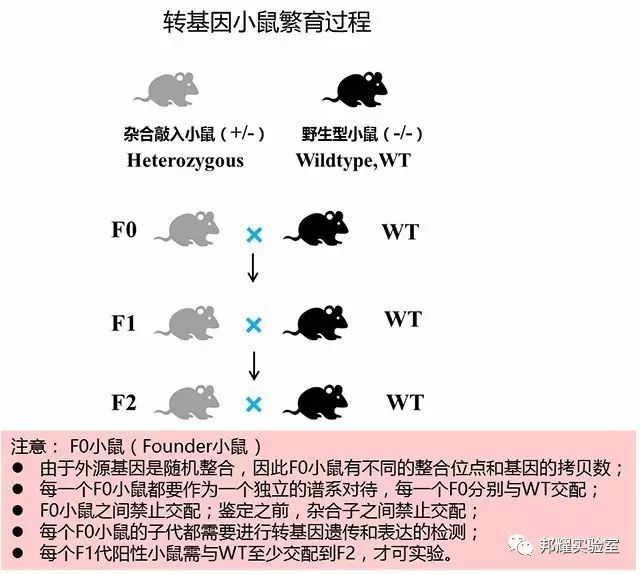
在上面的构建过程中,需要注意的是转基因小鼠繁育:
转基因技术的优点:
①外源DNA整合率高、容量大,DNA长达50kb仍然有效;
② 通常以多拷贝串连的方式插入,可以得到高拷贝的转基因小鼠;
③由于插入位点是随机的,可能通过一次注射就得到高、中、低表达水平不同的品系。
但是这个技术存在很大的缺陷:
①随机转基因的具体整合的位置是随机的,不可控的;
②外源DNA随机整合可能会破坏正常基因,诱发癌变,细胞凋亡等恶性结果;
③效率低,获得纯合子的转基因小鼠要一个相当长的筛选和纯化过程。
转基因小鼠应用:
转基因动物可以研究某些基因的特异性表达(包括表达强度、表达时间、表达部位)对个体的影响,如转入GFP示踪目的基因,从而研究某些基因的的特异性表达。目前转基因小鼠已为动物遗传模型的建立,肿瘤学研究,及转基因家畜的问世作出了巨大贡献。
其实,还有广义的转基因小鼠
随着基因编辑技术的发展,优势越发明显,因此这种随机的转基因小鼠日渐淡出我们的实验室。但是在很多文章和会议中,不严格来讲,仍然会把所有的与基因工程有关的小鼠(基因导入、敲除及敲入等)统称为转基因小鼠,这似乎也没有严格的对错之分。
在实验研究中,我们也不必太纠结这些所谓的命名,只需要明确研究目的,并结合已有的研究进展和技术,选择最合适的基因工程小鼠模型即可。