基因治疗的春天真的来临了吗?
本文系细胞培养俱乐部整理
作者:水木
个人或媒体如需转载,须在正文前注明"来源细胞培养俱乐部“
基因治疗是通过一定的载体将人的正常基因或有治疗作用的DNA导入人体的细胞中,去纠正基因的缺陷,从而达到对症下药的理想效果。
Alessandro Aiuti, Clinical Research Coordinator and Head of Unit
Lab members
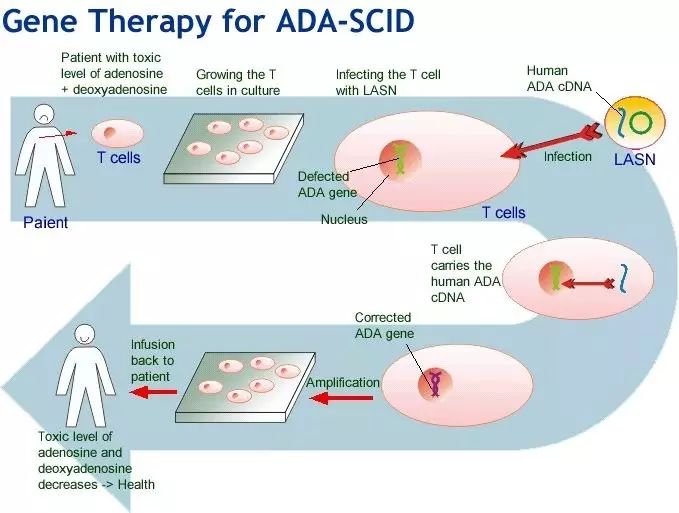
全球制药巨头葛兰素史克公司(GlaxoSmithKline,GSK)的基因疗法Strimvelis被欧盟批准上市,此基因治疗是世界上第一个被批准上市用于儿童缺陷基因修复的疗法,是基因治疗走向市场的又一里程碑事件。
每年在欧洲出生的儿童中大约有15~24名儿童患有极其罕见的基因疾病,这使得他们不能制造一种类型的白细胞。他们很少能活过两岁,除非他们的免疫系统在通过相匹配的骨髓移植后得以恢复。重度联合免疫缺陷症有时被称作泡沫婴儿 病,因为儿童出生时免疫系统如此的弱,以致他们必须生活在无菌环境中。
Strimvelis是第二个被欧盟批准上市的基因治疗方法药物,由意大利科学家与葛兰素史克公司共同开发,旨在的拯救少数没有可供使用相匹配捐献骨髓的腺苷脱氨酶缺乏性重度联合免疫缺陷症(ADA-SCID)儿童。
基因治疗药物的研究可以追溯到25年前,但这一领域经历了许多挫折,包括1999年出现一例备受关注的美国患者死亡及20世纪90年代后期与21世纪早期导致的一些灾难性临床试验。但现在乐观形势正在建立,更好方法的发现可以帮助把替代基因输送到细胞中。
盘点:第一个被欧盟批准上市的基因治疗方法药物Glybera
Glybera是一种基因疗法,利用一种腺相关病毒(AAV)将一个功能性LPL基因拷贝传递给骨骼肌,该药用于治疗一种极其罕见的遗传性、代谢性疾病——脂蛋白脂肪酶缺乏症(LPLD)。
LPLD是一种罕见病,发病率不超过百万分之一或二。LPLD患者无法处理血液中的脂肪颗粒,具有急性及潜在致命性胰腺炎症风险。在临床试验中,LPLD患者接受一次Glybera治疗后,就可以显著降低急性胰腺炎发病率。
Glybera于2012年10月获欧盟批准,是欧洲获批的首个基因治疗药物,是基因治疗领域的重大推动力,同时标志着基因治疗的一个里程碑。Glybera价格昂贵,每位患者的花费高达120万欧元(约合160万美元),因此也创造了昂贵现代医药的新纪录。相对于传统的蛋白替代策略,基因疗法能够提供更高的利益,因为基因治疗恢复了自然的身体机能,而不仅仅是短期修复。
盘点:全球第一个在中国批准上市基因治疗药物
p53基因是研究最透彻,功能最强大的一种抑癌基因。野生型p53对细胞周期和凋亡起关键性的控制作用,尤其是对受照射、细胞毒制剂、热疗打击的癌细胞,起更大的杀伤作用。放射线和化疗药导致肿瘤细胞周期阻滞,并引导细胞凋亡来杀伤肿瘤细胞,野生型p53促进凋亡,而p53基因的变异则减弱或取消这种效应,从而使肿瘤细胞对放疗和化疗产生抵抗性。50%以上人类肿瘤发生抑癌基因p53变异,这导致肿瘤的难治性,以及复发、转移和预后差。既往的临床实验已经证实了:重组人p53腺病毒本身有一定的治疗作用,更重要的是结合放疗、化疗和手术,能更明显地提高疗效。p53基因治疗已从实验室走向临床,走向产业化。国产的重组人p53腺病毒注射液(商品名“今又生”),经过5年艰苦的临床试验,充分证实对治疗头颈鳞癌是安全而有效的。2003年10月16日,国家食品药品监督管理局批准重组人p53腺病毒注射液新药证书,意味着世界上第一个癌症基因治疗药物在中国诞生,它标志着我国在基因治疗癌症临床和基因药物产业化方面都走在世界的前列。
重组人p53腺病毒是一种基因工程改造过的活病毒,在结构上由两部分组成:一是抑癌基因p53,二是载体。载体是改造过的无复制能力的腺病毒。就像火箭携带卫星上太空一样,这种携带p53的腺病毒特异感染肿瘤细胞,它可以有效地将治病的p53基因转入肿瘤细胞内,而对正常细胞无害。
美国于1995年起批准重组腺病毒p53制品进入临床试验。通过肿瘤局部注射、静脉注射、介入给药、胸腹腔灌注等方式,美国、日本、加拿大和欧洲的科学家开展了用重组腺病毒p53制品对头颈部鳞癌、乳腺癌、食道癌等数十种肿瘤的基因治疗。
我国是世界上较早开展基因治疗研究的国家之一。在国家863计划、国家重大科技专项和地方政府的支持下,经国家食品药品监督管理局批准,1997年底回国创立我国第一个基因治疗专业公司——深圳市赛百诺基因技术有限公司的彭朝晖教授等人在多年研究开发工作的基础上,于1998年开始将重组人p53腺病毒注射液进行临床试验,用于头颈部鳞癌治疗,并在深圳建立了通过国家GMP认证的基因治疗产品生产线和厂房。
迄今国内外已有超过300人接受了重组人p53腺病毒注射液的治疗。这一基因治疗药物在抗肿瘤上呈现出广谱性,与传统的放化疗联合应用呈现明显协同效应,治疗鼻咽癌等头颈部鳞癌的疗效显著。
今又生诞生”大事记:
第一阶段:Ⅰ期临床阶段。1998年3月9日,深圳市赛百诺基因技术有限公司成立;1998年12月28日,国家药品监督管理局批准重组人p53腺病毒注射液进入Ⅰ期临床试验;1999年1月,列入863计划生物技术领域中试开发项目;1999年11月,列入深圳市重点产业化项目;2000年7月,列入国家科技型中小企业技术创新基金项目。
第二阶段:Ⅱ期临床阶段。2000年10月7日,国家药品监督管理局批准重组人p53腺病毒注射液进入Ⅱ期临床试验;2000年12月,基因治疗制品生产厂房在深圳建成;2001年12月,列入国家科技攻关计划;2002年7月3日,获得国家知识产权局颁发的生产工艺发明专利;2002年11月,列入国家“十五” 重大科技专项;2002年11月22日,获得广东省药品监督管理部门颁发的《药品生产许可证》;2003年7月8日至9日,“基因治疗之父”弗伦奇·安德森博士访问赛百诺公司并签订合作研究开发协议书。
第三阶段:获得新药证书和正式上市阶段。2003年10月16日,重组人p53腺病毒注射液经国家食品药品监督管理局批准,获得新药证书。2004年1月20日,经批准获得准字号生产批文。
盘点:世界上第一个基因治疗死亡病例
1999年9月17日,18岁的亚利桑那男孩Jesse Gelsinger在美国宾州大学参加一项基因治疗的临床试验时不幸去世。
这是基因治疗诞生近十年以来第一例死亡病例,理所当然的收到了生物医学界、产业界和普罗大众的关注。就在当年,纽约时报的记者Sheryl Stolberg甚至用“死于生物技术”(A biotech death)来描述这场悲剧。
Jesse在两岁时被诊断出患有罕见的鸟氨酸氨甲酰基转移酶缺乏症(OTC,Ornithinetranscarbamylasedeficiency)。简单来说,这种单基因遗传病破坏了Gelsinger体内蛋白质代谢的机能,Jesse一旦蛋白质摄入过量,体内将会迅速积累大量的氨分子,从而危及生命。
今天朋友圈到处在转发GSK的获批新闻,难道基因治疗的春天真的来临?要是资本来推动,会不会再出现第二个魏则西呢?
参考出处:
http://www.gsk.com/en-gb/media/press-releases/2016/gsk-receives-positive-chmp-opinion-in-europe-for-strimvelis-the-first-gene-therapy-to-treat-very-rare-disease-ada-scid/
http://www.hsr.it/research/organization/institutes/sr-tiget/alessandro-aiuti/3/
http://www.wtoutiao.com/p/159FArX.html
http://www.y-lp.cn/pages/Article.aspx?id=5739514596027446618
http://www.sxjk.com/News/2007/1226/9296.shtml
http://mt.sohu.com/20160516/n449736600.shtml
http://www.bioon.com/industry/drug/592851.shtml
http://www.bioon.com/trends/news/351101.shtml
http://www.bioon.com/drug/law/80239.shtml