科研人员发现肿瘤恶病质的潜在基因治疗方法
12月5日,国际学术期刊《分子治疗》(Molecular Therapy)发表了中国科学院上海生命科学研究院营养科学研究所丁秋蓉研究组的最新研究成果Prevention of Muscle Wasting by CRISPR/Cas9- mediated Disruption of Myostatin In Vivo。该研究针对肿瘤病人中存在的严重肌肉萎缩病症,提出通过CRISPR在体特异靶向敲除肌肉组织中的肌生成抑制素(myostatin)达到延缓肌肉萎缩的治疗目的。
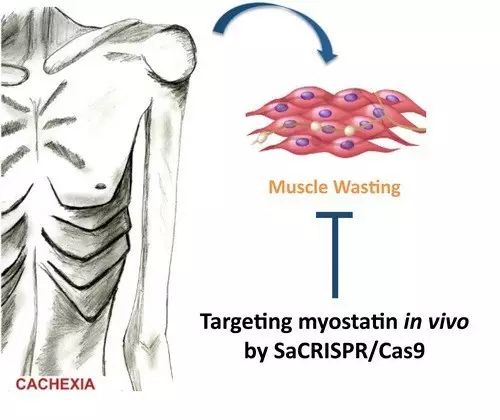
恶病质( cachexia )可见于多种疾病,其中以肿瘤伴发的恶病质最为常见。肿瘤恶病质是许多癌症患者(尤其是在疾病晚期阶段)所显示的一种消耗型综合征,表现为尽管有足够的营养摄入,但是仍发生骨骼肌的大量损失(同时伴随有或不伴随脂肪的减少),导致生活质量和生存率的严重下降。
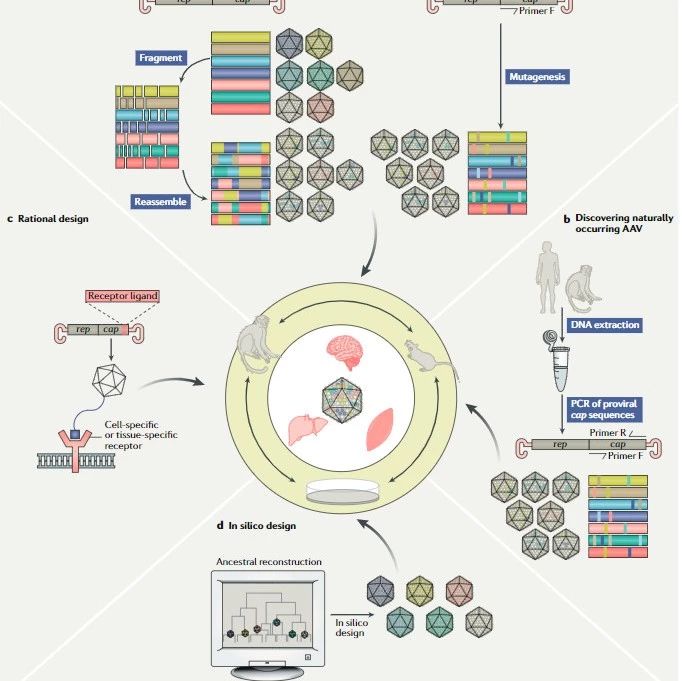
在此项研究中,研究生韦余达等在研究员丁秋蓉的指导下运用 SaCRISPR/Cas9 针对在恶病质中被激活进而诱导肌肉蛋白降解的 myostatin 信号通路,通过在体靶向敲除肌肉中的 myostatin 达到了部分缓解恶病质的效果。选择 myostatin 作为靶点的主要原因为:1)myostatin 信号通路为肌肉生长发育的负调控因素。已发现天然携带 myostatin 功能缺失突变的自然人,除肌肉系统强壮外,临床上没有发现其他严重不良影响,靶向安全性有所保证;2)前期的系列小鼠和临床试验证明 myostatin 信号通路在恶病质中起关键作用,而针对 myostatin 的单抗目前正处在临床试验期(针对胰腺癌病人的恶病质治疗);3)myostatin 主要由肌肉细胞分泌,主要作用方式是自分泌/旁分泌方式,因此局部肌肉微环境中的 myostatin 浓度降低便能在恶病质发生情形下保留部分肌肉功能。
基于此,韦余达等利用肌肉特异启动子启动 SaCas9 ( staphylococcus aureus cas9 )的表达,包装入腺相关病毒载体(AAV)后,通过定点注射小鼠腓肠肌组织靶向小鼠 Mstn 基因 (编码 myostatin 蛋白),在肿瘤诱导的恶病质小鼠模型中观察到骨骼肌功能的显著恢复(相比未靶向组小鼠,平均骨骼肌重量提高9%,平均抓力提高25%,并且在注射点处切片染色发现肌纤维萎缩得到明显缓解)。研究作为一个验证性实验,提示利用基因编辑特异靶向敲除肌肉组织中的 myostatin 可以作为防治恶病质的一个潜在基因疗法,而进一步提高体内靶向效率、全面评估靶向安全性将有助于其真正的临床转化。
该研究获得了营养所、中山医院、华东师范大学等支持以及中科院百人计划、国家青年千人计划和上海浦江人才计划的相关资助。
基因编辑特异靶向肌肉组织MSTN治疗恶病质
来源:中国科学院上海生命科学研究院