中医学者成功研发在体靶向基因编辑递送系统,有助于治疗恶性骨肉瘤
中医药研究院成功研发在体靶向骨肉瘤基因编辑递送系统,有助于治疗骨肉瘤。他们的论文(基于适配子功能化的肿瘤细胞特异性CRISPR/Cas9递送系统实现骨肉瘤VEGFA基因编辑)近日获得生物材料范畴的国际权威学术杂志《Biomaterials》刊登。
什么是CRISPR/Cas9技术
CRISPR/Cas9一种新兴的基因编辑技术, 2016年11月28日,CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas9最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。
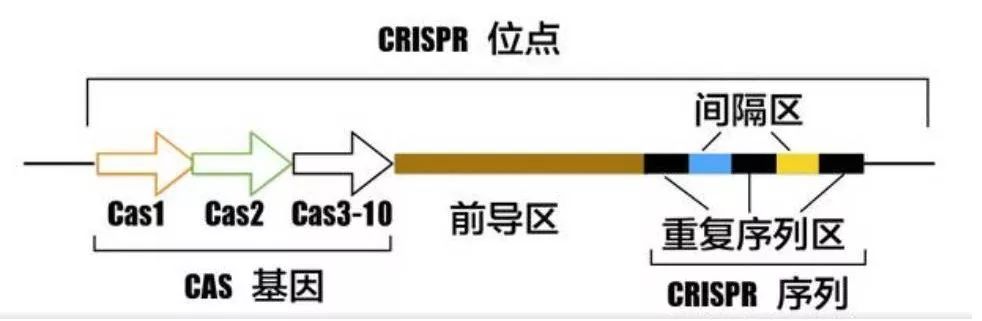
CRISPR/Cas9系统由不连续的重复序列R与长度相似的间隔区序列S间隔排列而成的CRISPR簇,前导序列以及一系列CRISPR相关蛋白基因cas等构成。Cas蛋白是一种双链DNA核酸酶,能在guide RNA引导下对靶位点进行切割。它与folk酶功能类似,但是它并不需要形成二聚体才发挥作用。
CRISPR/Cas系统的组成
CRISPR/Cas作用机理
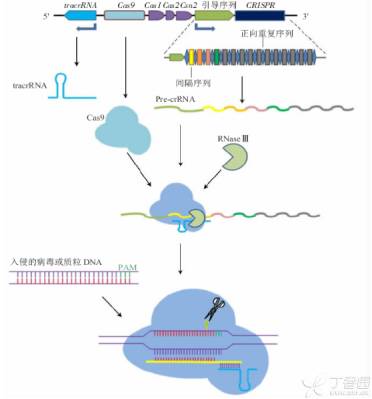
作用机理主要包括以下三步。
1、CRISPR的高度可变的间隔区的获得
首先,识别入侵的核酸和外源DNA的PAM(NGG序列),将临近PAM的序列作为候选原间隔序列protospacer;然后在CRISPR基因座的5’端合成重复序列;最后新的间隔序列整合到两个重复序列之间。
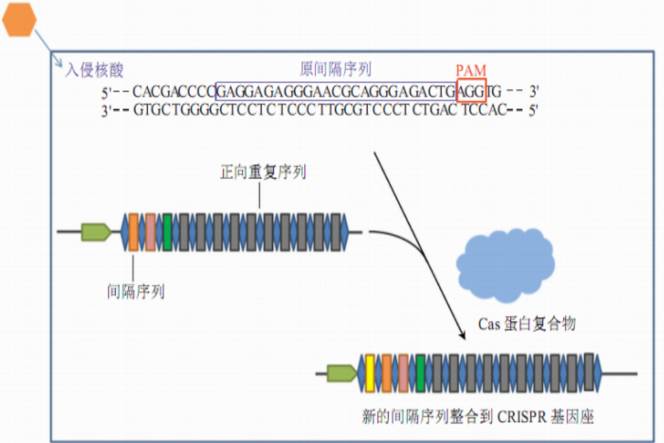
2、CRISPR基因座的表达
当该噬菌体再次入侵细菌时CRISPR簇首先转录为长的crRNA前体,然后逐步被加工小的成熟的crRNA。
3、CRISPR-Cas系统活性的发挥或是对外源遗传物质的干扰。crRNA结合相关的cas蛋白后形成crRNA-cas蛋白复合体,通过碱基互补配对精确的与目标DNA相结合,随后cas蛋白对目标DNA进行断裂和降解。
CRISPR/Cas作用机理
中医学者成功研究在体靶向基因编辑递送系统
CRISPR/Cas9已经被用于肿瘤分子机制和治疗靶点的研究,但是一直缺乏一种能够在体内靶向肿瘤的基因编辑递送系统,限制了该技术的临床转化。
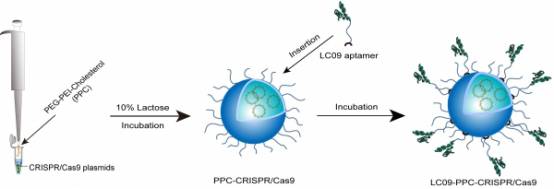
香港浸会大学研究团队针对问题的的症结,努力研究以骨肉瘤治疗为研究靶点,成功研发了适配子功能化的CRISPR/Cas9递送系统。
递送系统LC09-PPC-CRISPR/Cas9制备流程
研究团队由中医药学院院长吕爱平教授与研究开发部主人教学科研部副主任张戈教授率领。张戈教授说,骨肉瘤是儿童及青少年最为常见的原发性恶性骨肿瘤,目前的治疗方法是以手术与化疗为主,但手术后五年存活率仅为5%~20%。
适配子(Aptamer)是一类具三维结构的单链寡核苷酸,可以与特定细胞结合,已被广泛应用于药物的靶向递送。VEGFA基因已被证实为骨肉瘤治疗的潜在靶点。
吕爱平教授说,我们把识别肿瘤细胞的适配子作为靶向配体,与包装了CRISPR/Cas9的聚合生物材料偶联在一起,有利于实现肿瘤内的治疗性基因编辑。
在小鼠模型进行的实验中,该递送系统可加速CRISPR/Cas9在小鼠模型骨肉瘤和肺转移病灶的特异性聚集,促进肿瘤细胞的VEDFA基因编辑,抑制肿瘤恶化,降低肺转移,减少肿瘤组织血管增生,抑制骨破坏,并无明显毒性。该CRISPR/Cas9靶向递送系统加速了基因编辑策略在肿瘤治疗领域的临床转化应用。
(参与研究工作的还有浸大博士后研究学者梁超博士,研究助理教授李芳菲博士,博士研究生王璐瑶同学,中医药学院祝海龙博士研究团队成员王超博士,以及香港中文大学中医学院张宝亭教授研究团队的张宗康博士)
参考
https://www.ncbi.nlm.nih.gov/pubmed/28938163