【GeneThinkTank】除了检测基因突变,NGS在肺癌免疫治疗中还可以做什么?
GeneThinkTank 是涵盖了神经系统、呼吸系统、消化系统的科普专栏,点击文末“阅读原文”可查阅往期文章。
上期我们聊了聊影响免疫治疗疗效的基因突变,了解到通过NGS(高通量测序)可以检测多个基因的突变情况来辅助我们预测免疫治疗的效果。其实,除了这个用途以外,NGS在免疫治疗中还大有用武之地,不仅可以检测赫赫有名的TMB,还可以对免疫治疗疗效进行动态监测。
NGS用于检测不同癌种的TMB
TMB 和 bTMB
援引《美国国家癌症术语词典》中的定义,TB(Tumor burden)即肿瘤负荷指的是肿瘤细胞的数量或肿瘤的大小,那么引申一下,TMB即肿瘤突变负荷(Tumor mutation burden)指的就是肿瘤细胞内的基因突变数量,那bTMB就不难理解喽——血液肿瘤突变负荷(blood TMB)。
TMB与免疫治疗疗效的理论关系
在上一篇《免疫治疗的联合治疗——让肿瘤Hot起来》中,我们已经了解到,肿瘤细胞表面的特异抗原是影响免疫治疗疗效的重要因素,而根据前期的研究成果,科学家们发现,肿瘤细胞内的基因突变数量越多,产生的异常抗原就会越多,也越有可能“被免疫治疗”,这也就使TMB成为预测PD-1/PD-L1免疫治疗疗效的潜在标志物。因此,科学家们对接受免疫治疗的患者进行了回顾性分析,以探索肿瘤组织或血液中的TMB与免疫治疗疗效的关系,大致流程为:
TMB与免疫治疗疗效理论关系的实践结果
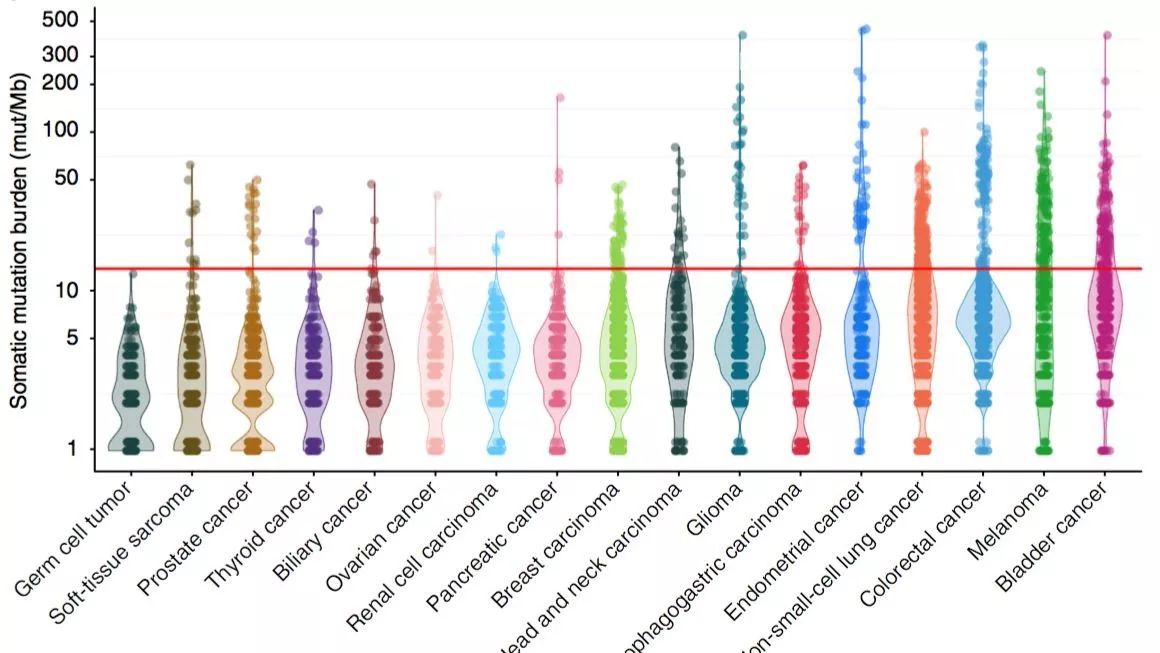
像预想的那样,TMB/bTMB与免疫治疗疗效理论关系在多个癌种中都已经得到了印证,图1结果表明,高TMB的癌种如黑色素瘤、dMMR(错配修复缺陷)的结肠癌、有吸烟史的非小细胞肺癌,免疫治疗的客观缓解率都是较高的(23-44%),而低TMB的癌种如尤文肉瘤、无吸烟史的非小细胞肺癌免疫治疗的客观缓解率均较低[1]。
图1. 各癌种肿瘤突变负荷与免疫治疗疗效正相关[1]
那么是不是所有PD1/PDL1相关免疫治疗药物的疗效都与TMB正相关呢?
目前肺癌获批的免疫治疗药物有三种:K药(Keytruda,Pembrolizumab)、O药(Opdivo, Nivolumab)和T药(Tencentriq, Atezolizumab)。这三种药物的疗效与TMB的关系已经有相关报道,汇总如图2:
图2. 肺癌获批PD1/PDL1免疫治疗的药物疗效与TMB呈正向关系[2][3][4]
图2A表明,高TMB的非小细胞肺癌患者使用pembrolizumab治疗后,PFS显著高于低TMB患者,且与持久的临床获益相关[2];
图2B表明,高TMB的非小细胞肺癌患者使用nivolumab治疗后,PFS显著高于化疗,低TMB的非小细胞肺癌患者使用nivolumab治疗后,PFS显著低于化疗[3];
图2C表明,TMB阈值不论选择9.9还是16.2,高TMB组患者使用atezolizumab的疗效显著更佳,而在多西他赛组(Doc),结果与之相反。
因此,从以上结果来看,对于肺癌来说,三种获批药物的疗效与肺癌患者的TMB均为正向的关系[4]。
bTMB与免疫治疗疗效关系的探索
以上所述的检测都是针对肿瘤组织中的TMB,而随着液体活检技术的发展,人们也开始探寻利用血液检测bTMB 。
然而,有关bTMB与免疫治疗疗效的研究还比较有限,2017年ESMO大会上,D.R. Gandara等报道了来自POPLAR和OAK研究,该研究对794例接受atezolizumab或多西他赛治疗非小细胞肺癌患者的bTMB进行了回顾性分析,比较在不同的bTMB阈值下,atezolizumab与多西他赛标准治疗的OS及PFS获益。结果如表1:
表1. bTMB不同阈值与atezolizumab疗效的关系[5]
注:BEP:可评估标志物人群;ITT:有意向分析人群
POPLAR和OAK研究中,无论bTMB阈值设置为10、16还是20,atezolizumab实验组与多西他赛实验组相比,在PFS和OS方面都是获益的。目前利用bTMB前瞻性判断免疫治疗疗效的II/III期临床实验正在进行中(BFAST,NCT03178552)[5]。
由此可见,利用bTMB预测免疫治疗疗效在未来也有着巨大潜力。
NGS用于免疫治疗疗效的动态监测
说到动态监测,我们提的更多的是通过液体活检对肺癌靶向治疗进行耐药或者复发监测,殊不知,NGS还可以用于免疫治疗疗效的动态监测,主要是通过血液中ctDNA水平以及特定基因的突变频率,来判断患者的免疫治疗疗效。
2017年8月发表在《Annals of Oncology》,研究者利用NGS的方法,对15名癌症患者(非小细胞肺癌、黑色素瘤、MSI-H的结直肠癌)免疫治疗前及免疫治疗后第8周的血液进行了检测,分析了血液中ctDNA水平与免疫治疗疗效的关系。结果如图3,可以看出,治疗前后ctDNA水平的变化与免疫治疗的疗效存在紧密的联系,治疗后ctDNA水平降低的患者,免疫治疗的效果也较好;治疗后ctDNA水平上升的患者,免疫治疗效果较差[6]。
,
图3. 治疗前后ctDNA水平与免疫治疗疗效的关系[6]
红色代表治疗前后均能检出ctDNA突变的患者
黄色代表治疗前后均未检出ctDNA突变的患者
蓝色代表治疗前能够检出而治疗后未检出ctDNA突变的患者
横坐标代表时间,纵坐标代表肿瘤大小
2017年9月,ESMO大会上的一篇报道中,研究者利用NGS的检测方法,对49名接受免疫治疗的非小细胞肺癌患者的血液进行了检测,结果见图4,免疫治疗后ctDNA水平下降的患者大部分表现出了部分缓解(橙色),而免疫治疗后ctDNA水平上升的患者却表现出了进展(绿色)[7]。
图4. 免疫治疗前后ctDNA水平变化与疗效的关系[7]
橙色指部分响应,紫色指疾病稳定,绿色指疾病进展
同时,这篇报道也向大家展示了两位免疫治疗疗效截然相反的非小细胞肺癌患者血液中ctDNA突变频率变化与免疫治疗疗效的关系,如图5:
图5.免疫治疗前后ctDNA水平变化与疗效的关系[7]
红色指基因突变频率,蓝色指肿瘤大小
左图是免疫治疗效果非常好的一位患者,我们从影像学的结果可以看出,患者接受免疫治疗后的第418天,肿瘤几乎完全消失,而患者血液中ctDNA的突变频率在第90天的时候,已经几乎检测不到了;而右图这位患者就没有那么幸运了,免疫治疗后第一个月,即表现出快速进展,血液中ctDNA的突变频率也在治疗后升高。这些结果进一步向大家展示了血液中ctDNA水平的变化与免疫治疗疗效之间的紧密联系[7]。
总结一下,NGS在免疫治疗过程中的指导作用主要为以下三个方面:
检测影响免疫治疗疗效的基因突变
检测免疫治疗的潜在标志物TMB
监测与免疫治疗疗效密切相关的ctDNA的动态变化
免疫治疗作为一种普适、长效、低毒的治疗方式,已经展示了其在癌症治疗领域的良好应用前景。与此同时,人们也在积极探索能够提高疗效、扩大获益人群的方法及标志物:从肿瘤外部的微环境着手,通过免疫治疗联合治疗的方式,将冷肿瘤变成热肿瘤;从肿瘤细胞的内部环境着手,通过NGS的检测方法预测及动态监测免疫治疗的疗效。作为肿瘤治疗领域热度持续上升的研究热点,相信免疫治疗“远方已不远”。
参考文献
[1] Yarchoan M, Johnson BA rd, Lutz ER, et al. Targeting neoantigens to augment antitumour immunity.[J]. Nature reviews. Cancer, 2017, 17(4):209.
[2] Rizvi N A, Hellmann M D, Snyder A, et al. Cancer immunology. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer.[J]. Science, 2015, 348(6230):124.
[3] Carbone D P, Reck M, Paz-Ares L, et al. First-Line Nivolumab in Stage IV or Recurrent Non-Small-Cell Lung Cancer[J]. New England Journal of Medicine, 2017, 376(25):2415.
[4] Alexa B.schrock, WCLC 2016.
[5] Gandara et al., ESMO 2017, Abstract #1295O.
[6]Cabel L, Riva F, Servois V, et al. Circulating tumor DNA changes for early monitoring of anti-PD1 immunotherapy: a proof-of-concept study[J]. Annals of Oncology, 2017, 28(8):1996.
[7] Goldberg et al., ESMO 2017, 1341P.

















