丁秋蓉组发现2型糖尿病易感基因突变的致病机制
责编丨迦溆
人类遗传学研究,如全基因组关联分析(GWAS)研究,为发现新的疾病易感基因,深入理解疾病发生规律提供了一种大规模的、无偏见性的、有充分人群基础的研究角度。然而由于人群多样性和遗传信息的复杂性,GWAS研究往往只提示了特定遗传突变和特定疾病发生之间的显著相关性,而两者之间是否存在直接的因果关系几乎未知。因而,深入挖掘遗传信息如何导致疾病发生的分子机制对深刻理解疾病发生的遗传学基础显得尤为重要。
2019年1月22日,中国科学院上海营养与健康研究院的丁秋蓉研究组在Cell Reports上发表了题为Gain-of-function mutations of SLC16A11 contribute to the pathogenesisof type 2 diabetes的研究成果。该研究发现SLC16A11基因编码区的2型糖尿病易感突变会产生功能获得性突变蛋白,导致肝脏脂滴不正常积累增多,进而导致2型糖尿病的发生。该研究结果对之前报道的认为此类易感突变导致蛋白功能缺失的研究结论提出了质疑。
2014年,一项针对墨西哥和拉丁美洲人群的GWAS研究发现在SLC16A11基因编码区的5个连锁单核苷酸多态性(SNP)与2型糖尿病的发生存在显著相关性,其中4个SNP涉及SLC16A11蛋白的4个氨基酸位点突变【1】。SLC16A11属于一元羧酸转运通道蛋白,定位于内质网上,其转运底物和基本功能未知。
2017年,来自麻省理工和Broad研究所的Eric Lander研究组针对这个基因组区域2型糖尿病易感突变的功能进行了深入研究【2】。他们的研究发现部分SLC16A11定位于细胞质膜,运输底物为丙酮酸。而人群中发现的SLC16A11编码区突变导致SLC16A11无法正常定位质膜,影响丙酮酸运输,继而导致肝脏脂滴积累增加,促使2型糖尿病的发生;研究同时提出通过提高SLC16A11表达水平或活性来治疗2型糖尿病的潜在策略。但这项研究主要基于体外细胞过表达体系得到结论,缺乏体内生理状态下的直接证据。
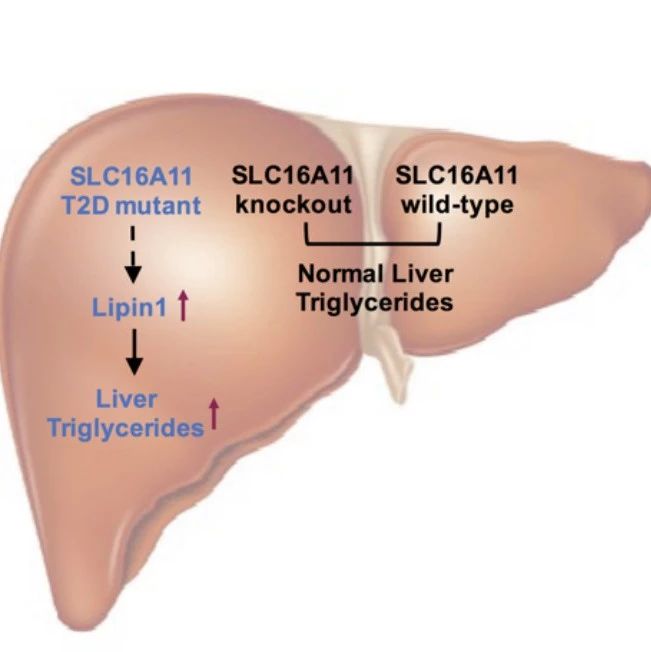
为在生理状态下进一步研究SLC16A11编码区突变的生理学功能,丁秋蓉课题组的研究人员构建了Slc16a11敲除小鼠;并发现相对于野生型小鼠,敲除小鼠在正常饮食和高脂饮食并没有出现代谢表型上的差异,提示SLC16A11蛋白缺失并不会对代谢平衡造成显著影响。
研究人员进一步在Slc16a11敲除小鼠的基础上,通过腺相关病毒在肝脏组织里特异回补蛋白表达的方式研究了突变体SLC16A11对代谢平衡的影响。研究发现回补表达突变体SLC16A11的小鼠,相比回补表达野生型SLC16A11或空载体的小鼠,在高脂喂养情况下表现出血液和肝脏甘油三酯的明显增加,同时发生葡萄糖耐受性和胰岛素敏感性的明显下降,提示胰岛素抵抗的产生。进一步机制研究发现突变型SLC16A11能够显著提高肝脏细胞Lipin1表达,促进肝脏甘油三酯合成,进而影响2型糖尿病的发病过程(下图)。
总的来说,该研究针对SLC16A11编码区2型糖尿病易感突变的作用机制提供了新的不同的解释,对前期研究人员提出的通过提高SLC16A11表达水平或活性来治疗2型糖尿病的治疗策略提出了质疑。此类编码区易感突变导致SLC16A11获得何种额外功能,SLC16A11突变体如何促使Lipin1表达上调,其他分子机制是否参与介导肝脏甘油三酯过度积累等问题仍需进一步深入研究。
据悉,该研究工作得到了中国科学院上海营养与健康研究院陈雁和应浩研究员、香港中文大学的吕爱兰教授、东莞理工大学马丹军教授的大力支持。中国科学院上海营养与健康研究院丁秋蓉研究员为通讯作者,博士后赵永旭,博士研究生冯庄慧和研究助理张永贤为共同第一作者。
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(18)32075-8
参考文献
1. The SIGMAType 2 Diabetes Consortium, Williams, A.L., Jacobs. S.B., Moreno-Macias, H.,Huerta-Chagoya, A., Churchhouse. C., Marquez-Luna, C., Garcia-Ortiz, H., Gomez-Vazquez, M.J., Burtt, N.P., et al. (2014). Sequence variants in SLC16A11 are a commonrisk factor for type 2 diabetes in Mexico. Nature 506, 97-101.
2. Rusu, V.,Hoch. E., Mercader. J.M., Tenen, D.E., Gymrek, M., Hartigan, C.R., DeRan, M.,von Grotthuss, M., Fontanillas, P., Spooner, A., et al. (2017). Type 2 DiabetesVariants Disrupt Function of SLC16A11 through Two Distinct Mechanisms. Cell170, 199-212.







