基因治疗药物递送系统研究进展(独家原创)
专家介绍
姜虎林:博士,教授,博士生导师。2012年入选江苏省特聘教授,2016年获得江苏省杰出青年基金项目资助。研究方向为智能型生物大分子药物的开发及其成药性研究。主持国家自然科学基金等科研项目10项,参与国家“863”计划项目等科研项目7项。作为通讯作者或第一作者在国际刊物发表SCI论文53篇,其中中科院JCR分区一区论文22篇,二区论文20篇;累计影响因子为258,他引1800多次,H指数31;申请专利26项,其中PCT专利4项,获得发明专利授权9项,其中一项已进入临床前毒性试验阶段;参编著作16部。
正文
基因治疗药物递送系统研究进展
王译,亓连玉,张程璐,刘笑影,邢磊,姜虎林*
(中国药科大学药学院,江苏 南京 210009)
[ 摘要] 基因治疗在癌症及许多遗传性疾病治疗方面有着重要意义。由于基因药物在体内很容易降解,为了有效地将基因药物递送至靶组织、靶细胞及靶细胞器发挥作用,开发安全高效的基因药物载体体系是十分必要的。随着基因治疗的发展和进一步完善,各类非病毒和病毒载体材料应运而生。针对各类基于非病毒和病毒载体的基因递送系统研究及其临床试验中的进展进行汇总。
1 基因治疗
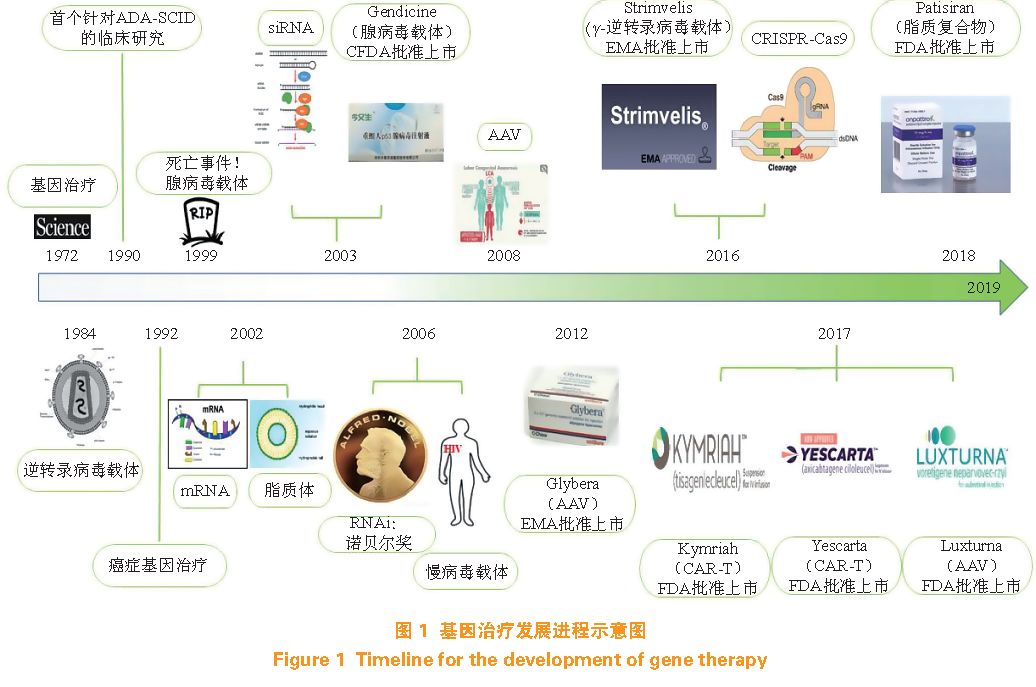
基因治疗(gene therapy)是指通过分子生物学方法,将正常或有治疗作用的基因导入靶细胞,以纠正或补偿因基因缺陷和异常引起的疾病,从而达到治疗或者改善某种疾病的效果。早在1972 年,美国著名生物学家Friedmann 和Roblin 在Science 上提出了基因治疗的概念。1990 年Blaese 等利用基因药物成功治疗重症联合免疫缺陷综合征(SCID-X1)患者。1999 年患有鸟氨酸氨甲酰基转移酶缺乏症的病人Jesse Gelsinger 接受不携带治疗基因的“空”腺病毒(adenovirus)载体后,多脏器衰竭,最终脑死亡。此次死亡事件使得基因治疗的发展受到极大的冲击与挑战。但是,随着基因治疗手段和基因递送体系的不断发展,学术界、产业界、FDA和大众对基因治疗的了解逐渐深入。2002 年修复信使RNA(mRNA)的基因治疗手段和脂质体的出现、2003 年小干扰RNA(siRNA)和腺病毒载体p53 基因药物今又生® 的问世都加速了基因治疗的发展。2006年,菲尔和梅洛因发现RNA 干扰现象(RNAi)获得诺贝尔生理学医学奖,此后,全世界再次掀起了基因治疗的研究热潮。逆转录病毒(retrovirus)、腺相关病毒(adeno-associated viral,AAV)等病毒类基因递送载体逐一进入临床试验。2016—2017 年期间,新型基因编辑手段CRISPR/Cas9 和嵌合抗原受体(CAR)-T 细胞疗法(CAR-T)的出现,使得基因治疗有了更多的可能性和更大的应用前景。直至2018 年,FDA 已批准4 款基因治疗药物(Kymriah®、Yescarta®、Luxturna®、Patisiran®)上市。基因治疗发展进程如图1 所示。
为了实现基因治疗,首先需要选择、获取目标基因以及靶点细胞,进一步利用适宜载体将目的基因导入靶细胞,最后则是外源基因在体内发挥作用。目的基因的合理选择是基因治疗的首要问题,这需要研究者首先深入了解导致疾病发生的异常基因序列,一般情况下,用于基因治疗的目的基因需有明确的遗传分子机制且该基因的异常是疾病发生的根源。对于单基因遗传病,如Leber 先天性黑曚、地中海贫血症等,突变基因单一,发病机制较为明确,因此基因治疗在此类疾病领域发展迅速。2017 年,美国FDA 批准用于治疗RPE65 基因突变导致的Leber先天性黑曚2 型疾病的药物Luxturna 上市。Luxturna 以RPE65 为目的基因,利用腺相关病毒将正常RPE65 基因导入患者体内,从而起到治疗的效果。Luxturna 不但能治疗Leber 先天性黑曚疾病,还能够治疗其他由RPE65 基因突变引起的眼疾。近年,肿瘤的基因治疗也取得了一定的进展,目前已上市的基因治疗产品中,Gendicine、Rexin-G、Kymriah 等均用于肿瘤疾病的治疗。虽然肿瘤的发生机制复杂,但大多数肿瘤细胞都存在一定的基因突变。Kymriah和Yescarta是已上市的针对血液肿瘤的基因治疗药物。由于95% 以上的B 细胞淋巴瘤和B 淋巴细胞白血病相关B 细胞均表达CD19 抗原,而其他非B细胞没有CD19 的表达,因此Kymriah 和Yescarta 均以CD19 为目的分子,制备特异性识别表达CD19 的功能性T 细胞,CD19 CAR 在T 细胞中的表达改变T 细胞的特异性,从而直接针对表达CD19 的靶细胞进行作用,实现对B 淋巴细胞肿瘤的治疗目的。Patisiran 是全球首个上市的RNAi 治疗药物,选择性降解转甲状腺素蛋白(TTR)的mRNA,避免毒性蛋白的合成,用于治疗遗传性TTR 介导的淀粉样变性。绝大部分已上市基因治疗药物及其靶基因见表1 。
在基因治疗中,除了需要准确选择目的基因外,还需要合适的载体材料递送基因。截至2018 年6 月,临床试验中超过70% 的基因药物载体为病毒载体,其中包括逆转录病毒、慢病毒(lentivirus)、腺病毒和腺相关病毒等。虽然病毒载体的出现极大推动了基因治疗的发展,但是仍存在一些局限性,如免疫原性强、细胞毒性较大等。而非病毒载体因其成本低、制备简单、安全性高等优点,越来越多地被用于基因治疗。
尽管如此,由于非病毒载体的转染效率达不到临床要求,迄今为止鲜有非病毒载体的基因药物批准上市。不过,随着材料科学及生物医药技术飞速发展,现已有一些用于基于非病毒载体材料的基因治疗药物进入临床试验阶段(见表2 )。
本综述主要讨论目前用于递送质粒DNA、siRNA、微小非编码RNA(microRNA,miRNA )、发夹RNA(shRNA)以及CRISPR/Cas9 的非病毒载体的研究进展。除此之外,本综述还着重关注病毒载体的临床应用以及相关上市药物的情况和病毒载体材料的临床试验进展。
2 基于病毒载体的基因治疗
目前已上市的基因治疗药物,除Patisiran® 外,均以病毒作为载体进行基因递送,虽然病毒载体具有免疫原性高、较大安全隐患以及生产困难等缺点,但是病毒载体具有较高的转染效率,高转染效率是基因药物研发的关键因素,因此病毒载体凭借其独特的优势仍然极具吸引力(见表3)。其中,逆转录病毒载体、腺病毒载体和腺相关病毒载体是目前在临床试验中应用较为广泛的基因治疗病毒载体。本文也主要对这3种病毒载体进行讨论。
2.1 逆转录病毒载体
逆转录病毒是一种单链RNA 病毒,能整合到宿主基因组上并在体内逆转录酶的作用下将RNA 逆转录为DNA,通过进一步的转录、翻译以及包装生成新的病毒。大多数逆转录病毒仅在分裂细胞中才有活性。在基因治疗中运用较多的是γ- 逆转录病毒和慢病毒(lentivirus)。
研究人员早在1984 年就已成功构建逆转录病毒载体,有效地将外源基因导入哺乳动物的染色体中,之后,采用γ-逆转录病毒对自身离体骨髓细胞进行转染,开展了第一个人类基因治疗试验。随着逆转录病毒研究的不断深入,其也被应用于造血干细胞(HSCs)和CAR-T 的转染。2007 年, 菲律宾NFA 批准Rexin-G® 上市用于治疗各种实体瘤,该药由逆转录病毒装载细胞周期蛋白基因组成,随后,又由美国FDA批准上市用于治疗胰腺癌。2016 年,EMA 批准葛兰素史克公司研发的Strimvelis® 上市,该药同样是利用γ-逆转录病毒负载基因用于腺苷脱氨酶缺乏性重度联合免疫缺陷症的治疗。2017 年FDA 批准上市的2 种基因治疗药物中均是使用γ-逆转录病毒对T 细胞进行改造。目前也有一些临床试验使用γ-逆转录病毒用于X 染色体连锁重度联合免疫缺陷病、B 细胞淋巴瘤或慢性淋巴细胞白血病和急性淋巴细胞白血病的治疗(见表3)。
与其他类型的逆转录病毒相比,慢病毒具有在一些不分裂细胞中发挥作用的能力。在临床试验中,由于慢病毒载体可以进行多功能改造并在T 细胞中稳定表达,慢病毒载体在该治疗中的作用也受到越来越多的关注。同时,基于慢病毒载体转染造血干细胞的临床试验也取得了较大进展,其中包括许多儿童罕见疾病(如伴X 染色体肾上腺脑白质营养不良、维斯科特-奥尔德里奇综合征等)。除此之外,也有研究者利用慢病毒载体治疗β-地中海贫血。目前,这些研究均处于临床试验阶段。
2.2 腺病毒载体
腺病毒是一种具有二十面体蛋白衣壳的中型病毒,包含有36 000 个碱基对的线性双链DNA。腺病毒进入宿主后会迅速复制、组装产生10 000 个子代病毒粒子。在实体瘤治疗中,溶瘤腺病毒展现出较大的应用前景,有研究人员用胰腺癌靶向受体SYENFSA(SYE)修饰溶瘤腺病毒从而感染胰腺癌细胞,达到较好的抑癌效果。但是由于溶瘤腺病毒无法识别感染远端的肿瘤,因此为了进一步提高溶瘤腺病毒的疗效,Emdad 等利用微泡包裹嵌合5 型和3 型腺病毒载体构建了一个“隐形”递送体系,该体系还能在超声作用下释放载体材料发挥药效。2004 年,原国家食品药品监督管理总局(CFDA)批准的今又生® 便是利用腺病毒装载p53 基因用于鼻咽癌治疗的药物。
2.3 腺相关病毒载体
腺相关病毒是一种能够感染人或其他灵长类动物的小型病毒。腺相关病毒根据来源不同分为不同的血清型,其中AAV2、AAV3、AAV5 和AAV6 的宿主是灵长类动物,AAV1、AAV4、AAV7、AAV8、AAV9、AAV10、AAV11 的宿主是非人灵长类动物。与其他病毒不同,单独的腺相关病毒没有明显的致病性、能感染到人染色体19 的特定位点(称为AAVS1)、免疫原性较低。
基于腺相关病毒的优势和特点,腺相关病毒已有2款药物上市:1)2012 年EMA 批准Glybera® 用于治疗脂蛋白酯酶缺乏遗传病(LPLD);2)2017 年FDA 批准Luxturna® 用于治疗Leber 先天性黑曚引起的失明。与此同时,目前还有许多腺相关病毒的基因治疗药物处于临床试验阶段。一项治疗肝脏血友病B 的临床试验显示,AAV8 载体能改善药物的肝脏靶向性,同时增强药物在动物水平的转染效率。除此之外,现已有3 项临床试验是使用AAV2 载体治疗Leber 先天性黑曚疾病。
2.4 其他病毒载体
除了上述介绍的3 类在基因治疗中受到广泛应用的病毒载体之外,疱疹病毒(herpes simplex viruses)、柯萨基病毒(coxsackie virus)、新城病毒(newcastledisease viruses)等载体也有处于临床试验阶段的基因治疗药物(见表3)。
3 基于非病毒载体的基因治疗
3.1 有机材料基因递送体系3.1.1 脂质体
目前,脂质体在临床的诸多领域中被广泛应用,如疫苗和基因药物递送、癌症治疗、肿瘤影像学等。基因药物如质粒DNA、siRNA、microRNA、CRISPR/Cas 等通过表达治疗性蛋白、沉默病理基因或基因编辑来治疗疾病。由脂质体介导的基因转染是基因治疗最早、也是应用最为广泛的非病毒转染策略之一。
中性脂质具有低毒性和低免疫原性等优点,但其对基因的负载能力及转染效率较低;阳离子脂质有更高的基因负载和转染能力,虽有较高的毒性,但可以通过聚乙二醇(PEG)化修饰等手段改善。在基因递送研究中,最常用的阳离子脂质有N-[1-(2,3-二油酰氧基)丙基]-N,N,N-三甲基氯化铵(DOTMA)、1,2-二油酰基-3-三甲基铵丙烷(DOTAP)、2,3-二油基氧基-N-[2-(精胺甲酰胺基)乙基]-N,N-二甲基-1-丙铵三氟乙酸盐(DOSPA)和1,2-二肉豆蔻基氧丙基-3-二甲基羟乙基溴化铵(DMRIE)等。阳离子脂质体通常由中性脂质[ 胆固醇、卵磷脂、磷脂酰胆碱(PC)、二硬脂酰基磷脂酰胆碱(DSPC)、二油酰磷脂酸乙醇胺(DOPE)] 等与阳离子脂质共同组成,中性脂质作为“辅助脂质”可以稳定双层膜、降低阳离子脂质的毒性和增强转染等。
另外,有研究者将阳离子脂质体作为载体开发DNA 疫苗。Tian 等构建了一种由二甲基双十八烷基铵(DDA)、单磷酰脂质A(MPLA)和海藻糖6,6'-二山嵛酸酯(TDB)组成的脂质体(DMT)。DDA脂质介导脂质体与抗原递呈细胞(APC)的初始接触,MPLA 增强CD4+T 细胞免疫应答并降低脂质体表面电荷,TDB 激活APC,MPLA 和TDB 提高脂质体的稳定性。将脂质体与编码分泌融合结核分枝杆菌多重抗原的质粒pCMFO 制备成DNA 疫苗,给予C57BL/6 小鼠后发现,该疫苗可以缓慢持续释放DNA 和激动剂,并在脾脏中引发显著的免疫原性。
脂质体除了用于递送DNA 之外,也广泛用于各类RNA 的递送。目前,基于脂质/ 脂质体修饰的RNAi 技术已广泛应用于眼部疾病和肿瘤的治疗。其中,利用脂质或脂质体递送siRNA 是RNAi 技术在眼睛局部应用中最常用的一种策略,约占38%;在局部递送siRNA治疗肿瘤的研究中,选择脂质或脂质体/siRNA 复合物的多达25% 。除了递送mRNA,RNAi 技术还包括递送miRNA。迄今为止,已经鉴定出几种关键的miRNA可以抑制小鼠肿瘤的生长,其中包括let-7,miR-16,miR-34 和miR-26a [49-52],因此miRNA 介导的基因治疗成为治疗癌症的潜在方法。
与siRNA 相比,shRNA 具有较高的效力和可持续的效果。为靶向递送Toll 样受体4(TLR4)特异性的shRNA,Zhang 等使用冷冻干燥法制备3α-[N-(N,N-二甲基氨基乙烷)-氨基甲酰基] 胆固醇-二油酰磷脂酸乙醇胺[DC-Chol-DOPE(物质的量比4 : 3 : 3)] 的阳离子脂质体偶联维生素A(VA),作为药物载体递送TLR4 shRNA(VA-lip-shRNA-TLR4),诱导胰腺星状细胞线粒体凋亡,达到治疗胰腺纤维化的目的。
上述研究中构建的载体主要是直接递送核酸至靶标部位进行基因修复或沉默,而近年来已被广泛应用的CRISPR/Cas9 系统是基因编辑的一种新的强大手段。但是,CRISPR-Cas9 系统也存在某些缺点,限制了该方法的应用,如Cas9/sgRNA 融合质粒的体积太大(> 10 000bp),难以用普通载体负载。因此,需要更加合适的载体体系对其进行递送。Zhang 等设计了一种由DOTAP-DOPE-Chol 组成的新型阳离子脂质载体,与鱼精蛋白、Cas9-sgPLK-1 质粒DNA、硫酸软骨素(CS)的三元复合物结合,在其表面进一步修饰二硬脂酰磷脂酰乙醇胺-聚乙二醇(DSPE-PEG)后,发现CRISPR-Cas9 系统抑制肿瘤生长的效果明显优于siRNA。该体系中软骨素使Cas9/sgRNA 融合的质粒DNA 更强地附着到鱼精蛋白上,其中鱼精蛋白能够很好地凝聚压缩Cas9/sgRNA 融合的质粒DNA,使其在不缩短DNA 序列的条件下使质粒体积最小化,形成紧密的核心。DSPE-PEG 在阳离子脂质表面上的进一步修饰能有效降低复合物和血清或细胞外基质的非特异性相互作用和细胞毒性,从而提高转染效率。
由于各类脂质设计的非病毒脂质纳米粒子(LNP)递送系统具有易于制备、减少免疫反应、多剂量容量、更大的有效荷载以及设计的灵活性等优势,目前已有不少基于LNP 的基因治疗药物处于临床研究阶段(见表2)。
3.1.2 聚乙烯亚胺及其衍生物
根据分子结构划分,聚乙烯亚胺(PEI)分为线状和分支状两大类,其中分支状PEI 常被用作基因载体材料。PEI 是一种具备伯胺、仲胺、叔胺的阳离子聚合物,每3 个原子包含1 个氮原子。由于PEI 的以下理化性质,高氨基密度的PEI 被认为是最理想的阳离子基因递送材料之一:1)PEI 带正电性,利于复合物与细胞膜的作用,从而促进细胞摄取,并且通过静电作用将基因压缩形成纳米级复合物;2)PEI 保护基因避免被核酸酶降解;3)由于PEI 的高氨基密度,具有较强的质子缓冲能力,促进复合物溶酶体逃逸。但是,PEI 的强正电性也导致较强的毒性和血浆不稳定性,并且PEI 与基因形成的复合物易被巨噬细胞和网状内皮系统清除,从而降低基因递送效率。
研究者们采用多种方法对PEI 进行修饰以改善PEI的性能。Jiang 等以PEI 为骨架材料,与PEG、细胞穿膜肽(TAT)合成PEI-PEG-TAT(即PPT),共递送PEI 修饰的阿霉素(Dox-PEI,DP)和肿瘤坏死因子相关凋亡诱导配体基因(TRAIL)。另外,在PEI表面修饰两亲性高分子材料,能够增强转染效率。Ewe等将低相对分子质量PEI 和二棕榈酰磷脂酰胆碱(DPPC)构建形成脂质复合物,并用于递送siRNA。通过共价键在PEI 表面修饰多肽、糖类、抗体等也能够有效提高基因递送效率。Ke 等构建氨基甲酸酯-甘露糖修饰的PEI,用于靶向递送NF-κB shRNA 至肿瘤干细胞,与未修饰的PEI/shRNA 复合物相比表现出较低的毒性和较高的转染效率。更值得关注的是,氨基甲酸酯-甘露糖-PEI/shRNA 复合物能够诱导细胞凋亡,抑制肿瘤浸润转移。非生物可降解性是PEI 应用受到限制的一个重要原因。使用响应性连接键交联低相对分子质量PEI 在一定程度上可以解决此问题,比如还原性二硫键或者酯键。Nam 等设计聚(胱胺-二丙烯酰胺-己二胺)[poly(CBA-DAH)] 作为生物可降解性基因递送载体,并将PEI 与poly(CBA-DAH)通过二硫键连接形成PEI-CBA-DAH(PCDP), 结果,PCDP/DNA 在较低质量比的情况下,可以获得与PEI(相对分子质量为25 000)相似的转染效率。除了通过修饰PEI 得到理想的基因载体,利用PEI 与药物结合形成前药后与基因共递送的治疗策略也有较好的治疗效果,比如Zhang等利用PEI 与斑蝥素或者铂类药物结合形成聚合物前药后,与Akt1 shRNA 共递送至肿瘤部位,抑制肿瘤的生长和转移。
以PEI 为骨架的多种载体材料已经应用于多种疾病的基因治疗临床试验,包括卵巢癌、胰腺癌、原发性腹膜恶性肿瘤、多发性骨髓瘤等。治疗卵巢癌的基因治疗药物BC-819(NCT00826150)和治疗胰腺癌的基因治疗药物DTA-H19(NCT00711997)已完成临床Ⅰ期和临床Ⅱ期试验;除此之外,用于治疗顽固或者周期性卵巢癌、输卵管或者原发性腹膜恶性肿瘤的腹腔注射药物制剂EGEN-001(NCT01489371)也已完成Ⅰ期临床试验。
3.1.3 阳离子多肽
阳离子多肽可以通过静电作用有效结合核酸分子,多肽具有较好的生物相容性、生物可降解性、较高的核酸负载和细胞摄取能力,但由于内涵体逃逸能力差,其转染效率低。
利用多肽导向的非病毒基因传递与其他基因治疗策略相比具有明显的优势。与病毒载体不同,多肽具有较低的细胞毒性和免疫原性,并且存在其他非病毒载体不具备的特定功能,如促进DNA 缩合、辅助内涵体逃逸、核运输和特定受体靶向等,从而有效提高载体的基因转染能力。另外还可以通过干扰疾病相关物质合成,干扰疾病发生发展。目前,多肽作为非病毒递送载体仍处于研究阶段,随着各种新型多肽的合成,其潜在的应用价值将会被进一步开发。
目前,大多基于多肽的递送载体领域的研究集中于提高转染效率以及体外研究,且没有明显的证据可以证明体内外结果的关联性以及体内的安全性,因此还有很多体内研究需要推进。
3.1.4 树形分子及其衍生物
树形大分子是一类具有高分支度、低分散度和高功能化等特点的合成大分子,主要由3 部分结构组成:1)启动程序的核;2)与核紧密连接的内层重复单元;3)与内层连接的最外层末端功能基团。由于树形大分子表面带有可修饰的氨基基团,在生理条件下被质子化呈正电性,能够与带负电荷的DNA、RNA 以及细胞表面的黏多糖通过静电作用结合,因此可用于构建高效基因递送载体。
目前,研究最为广泛的2 种树形大分子是聚酰胺-胺(PAMAM)和聚丙烯亚胺(PPI)。
PAMAM 树形大分子内部叔胺基团具有pH 缓冲能力,促进复合物的溶酶体逃逸,没有免疫原性,因此降低基因递送的安全隐患。Liu 等首次报道基于两亲性树形大分子(AD)自组装形成多功能载体用于递送siRNA 和基因沉默,并且在体内研究证明此结构在初生细胞和干细胞的递送效率较高。除了用于siRNA的递送外,树形分子还可以用于递送miRNA,例如,使用G5-PAMAM 载体共递送as-miR-21 反义寡核苷酸与5-氟尿嘧啶至人恶性胶质瘤细胞,该递送手段大大增强治疗效果。为了获得更高的基因转染效率和靶向递送能力,在PAMAM 修饰靶向基团,比如多肽、叶酸(FA)、生物素、转铁蛋白、抗体、表皮生长因子和PEG 等。此外,基于树形大分子的药物与基因的共递送系统也受到越来越多的关注。Gu 等设计构建氧化石墨烯PAMAM 树形大分子(GO-PAMAM),共递送阿霉素和MMP-9 shRNA 用于乳腺癌治疗。
另一种广泛应用于基因治疗的树形分子是PPI,由于其结构中存在氨基基团(通常末端为伯胺,内层包括大量的叔胺),因此PPI 不仅能负载基因还能实现溶酶体逃逸。Franiak-Pietryga 等构建了由麦芽三糖残基修饰的PPI(糖树状分子),发现麦芽三糖修饰的PPI 通过影响TRAIL 相关的基因表达起到较强的促凋亡作用。
3.1.5 壳聚糖及其衍生物
壳聚糖(CS)是一种生物可降解的多聚糖,包括D-氨基葡萄糖和N-乙酰-D-氨基葡萄糖重复单元,通过α-(1-4)糖苷键相连,具有良好的生物相容性和较小的体内毒性。壳聚糖作为基因载体的潜能主要源于其正电性:当环境中pH 值低于壳聚糖pKa(其pKa 为5.5 )时,壳聚糖的伯胺基团呈现正电性,这些质子化的氨基能够使壳聚糖通过静电作用与带负电荷的DNA 结合;在中性或者碱性条件下,壳聚糖带少量的正电荷,此时与DNA 之间的作用力除静电作用外,同时还存在氢键、疏水作用等作用力。此外,在基因治疗中,壳聚糖的相对分子质量、脱乙酰化度、氮磷比(N/P)、细胞类型,均会影响壳聚糖/DNA 复合物的转染效率。
尽管壳聚糖作为非病毒基因递送载体具备很多优点,但是由于较低的转染效率,应用受到限制。在壳聚糖上修饰一系列疏水基团,包括5β-胆烷酸、去氧胆酸、硬脂酸和烷基链等有利于减少壳聚糖复合物聚集、提高其与细胞表面的相互作用。其次,提高壳聚糖的阳离子性质,提高其缓冲能力;同时,对壳聚糖进行细胞特异性配体修饰提高靶向性,从而增强基因转染效率。Kim 等在前期研究中构建CS-PEI(CP)递送基因,但是缺乏细胞靶向性,因此,在后续研究中,该团队以FA 作为靶向配体,构建FAPEG-CS-PEI 载体系统,有效增强载体的细胞靶向性;除了FA 配体,该团队后期使用CS-PEI 和线粒体转运蛋白配体PK11195 修饰超顺磁氧化铁(SPION)构建PK-CP-SPION,协助线粒体靶向基因递送。在外磁场作用下,PK-CP-SPION 聚集在线粒体,激活线粒体凋亡路径。与PEI 相比,PK-CP-SPION 作为载体递送基因,转染时间更短,因此,可作为磁性靶向基因递送载体加强肿瘤治疗效果。
3.1.6 聚氨基酯
聚氨基酯(PAE)是一类通过伯胺或仲胺与二丙烯酸二乙二醇酯反应合成的、能够通过水解反应降解的聚胺类阳离子聚合物,有利于细胞摄取和溶酶体逃逸,广泛用于基因递送。
Kim 等利用三丙烯酸三羟甲基丙酯(TT)和精胺(SPE)合成聚氨基酯结构,用于靶向递送siRNA,此载体递送系统保护siRNA 避免被RNA 酶A 降解,与PEI 相比,具备较好的细胞摄取能力和有效的基因沉默效率。Minai Tehrani 等利用丙氧基化甘油三丙烯酸酯(GPT)和SPE 构建聚氨基酯类载体GPT-SPE,递送靶向骨调素的siRNA,在乳腺癌异种移植模型中,GPT-SPE 递送siRNA 沉默骨调素,有效抑制乳腺癌细胞的生长。在此基础上,Kim 等进一步对GPT-SPE半乳糖化,增加靶向性,用于治疗肝癌,显著增强特异性和有效性。PEI 与精胺相似,具有较多的氨基基团,因此正电性较强。Wang 等利用低相对分子质量PEI与普朗尼克构建聚氨基酯类聚合物,通过调节PEI 相对分子质量和选择不同脂水分配系数的普朗尼克进行筛选,最终结果表明,在细胞实验中,使用相对分子质量为3 000 ~ 5 000 的PEI,脂水分配系数为12 ~ 18 的普朗尼克构建的聚氨基酯类化合物表现出最高的转染效率。
3.1.7 环糊精及其衍生物
环糊精(CD)是天然大环低聚糖结构,由α-(1-4)糖苷键连接构成具备篮筐形状的拓扑结构。葡萄糖单元的羟基朝向外面,5 位氢和3位氢朝向内腔,具备内部疏水、外部亲水的两亲性特性,通过隐蔽作用,避免基因载体系统与体内分子的非特异性结合,有利于提高基因载体系统的稳定性。另外,环糊精会与生物膜发生相互作用,导致特定膜成分的释放,从而引起生物膜的不稳定性、增加生物膜的通透性。
Zhang 等分别在环糊精6 位羟基和2 位羟基位置修饰PEI, 得到PEI-6-CD 和PEI-2-CD。随后, 与以二茂铁(Fc)末端修饰的PEG(PEG-Fc)结合,以PEI 修饰的环糊精作为主体、PEG-Fc作为客体,构建超分子聚合物。利用此结构递送MMP-9shRNA 发挥抗肿瘤作用。除了递送shRNA,有研究者以环糊精为基础设计超分子聚合物递送siRNA,Liu 等将聚β-环糊精与PEG-金刚烷修饰的PEI 通过主客体作用构建超分子聚合物与siRNA 结合,该体系具备良好的细胞相容性和转染活性。
以环糊精作为基本骨架构建的纳米粒是应用到癌症临床试验中的第1 种siRNA 递送系统。用于靶向核糖核苷酸还原酶mRNA(RRM2)的环糊精聚合物siRNA 递送系统进入Ⅰ期临床试验,该临床试验已于2013 年终止。
3.2 无机材料基因递送体系
相比于有机材料,无机纳米材料具有特定的性质,例如:尺寸可调、比表面积大、易于表面修饰等。通常来说,有3 种策略用于修饰无机纳米粒进行基因递送:第1 种策略是将负电基因与正电无机纳米粒形成复合物;第2 种是将基因以响应性共价键形式连接在纳米粒上;第3 种则是在无机纳米粒表面修饰两亲性高分子,负电荷基因通过静电作用吸附在高分子层中。
目前,已有的无机材料包括金纳米粒(AuNPs)、碳纳米管(CNTs)、石墨烯、量子点(QDs)、上转换纳米粒(UCNs)、二氧化硅纳米粒(MSN)被广泛应用于质粒DNA 和RNA 递送。截至目前,仍未见无机纳米材料递送基因用于临床,但是随着研究的不断深入,无机材料有潜力成为临床上基因治疗的新工具。
除了传统意义上构建的有机、无机材料体系外,许多研究也设计了其他类型的递送材料用于基因治疗,例如:无机-有机杂化体系、基于氟化材料的载体体系和蛋白载体递送体系等。这些体系在一定程度上克服了传统递送体系的一些缺点,因此它们为基因治疗的发展提供了新的可能性。
采用无机-有机杂化方式构建的载体材料不仅能克服2 种材料各自的缺点,还能充分发挥材料本身特有的性质。因此,越来越多的研究利用无机-有机杂化体系进行基因递送。通常来说,该体系主要分为3 种类型:1)在无机纳米粒表面修饰有机材料得到的杂化体系;2)金属材料为核、有机材料为壳的壳核杂化体系;3)非金属材料为核、有机材料为壳的壳核杂化体系。
基于氟化材料构建的递送体系能在一定程度上增加载体的基因递送效率。截至2014 年,含氟药物已占所有上市药物的25% 左右,因此,氟化材料作为基因载体也有潜力应用于临床研究。
除此之外,还有研究者利用天然蛋白构建基因递送载体,其通过分子识别等非静电作用包载基因发挥作用。最重要的是,体系中使用的核糖核蛋白是一种人源蛋白,使得纳米粒表面带负电荷且较阳离子载体具有更低的免疫原性,非常有潜力应用于临床研究。
4 结语与展望
在过去的几十年中,基因治疗已经在癌症和各种遗传学疾病的治疗中取得了重大进展。随着各类基因递送系统的更新换代,非病毒载体尤其是有机材料因具有特殊性质和优势,在基因治疗的舞台上脱颖而出。基于有机材料的非病毒载体基因治疗递送系统总结如表4 所示。本综述主要总结了有机、无机及其他递送系统近几年来的发展进程以及病毒载体的临床应用情况,旨在为将来基于非病毒载体和病毒载体的基因治疗提供思路与参考。
当然,无论是非病毒载体还是病毒载体在临床应用上都面临着许多挑战。譬如,复合递送体系的自身毒性、基因编辑时基因脱靶带来的基因毒性、基因载体的免疫原性、相关伦理道德和政府监管问题等。其中,尽管病毒载体的转染效率非常高,但是病毒载体在基因治疗中最需要克服的问题是其自身的毒性和免疫原性。所以,今后基于病毒载体的递送体系应该在确保其高转染的前提下进一步降低其毒性和免疫原性。尽管非病毒载体具有成本低、制备简单、安全性高、可修饰等优点,但阻碍非病毒载体推向临床的主要障碍是其较低的转染效率。因此,进一步构建高效低毒的非病毒载体材料刻不容缓。总之,采用“扬长补短策略”所开发的病毒或非病毒的创新递送体系有望进一步加快基因治疗的发展,并为癌症和许多遗传性疾病提供一个安全高效的治疗平台。
关于我们
●感谢您阅读《药学进展》微信平台原创好文,也欢迎各位读者转载、引用。本文选自《药学进展》2018年第12期。
●《药学进展》杂志, 由中国药科大学和中国药学会共同主办、国家教育部主管,月刊,80页,全彩印刷。刊物以反映药学科研领域的新方法、新成果、新进展、新趋势为宗旨,以综述、评述、行业发展报告为特色,以药学学科进展、技术进展、新药研发各环节技术信息为重点,是一本专注于医药科技前沿与产业动态的专业媒体。
《药学进展》注重内容策划,加强组稿约稿,深度挖掘、分析药学信息资源,在药学学科进展、科研思路方法、靶点机制探讨、新药研发报告、临床用药分析、国际医药前沿等方面初具特色;特别是医药信息内容以科学前沿与国家战略需求相结合,更加突出前瞻性、权威性、时效性、新颖性、系统性、实用性。根据最新统计数据,刊物篇均下载率连续三年蝉联我国医药期刊榜首,复合影响因子0.760,具有较高的影响力。
《药学进展》编委会由国家重大专项化学药总师陈凯先院士担任主编,编委由新药研发技术链政府监管部门、高校科研院所、制药企业、临床医院、CRO、金融资本及知识产权相关机构百余位极具影响力的专家组成。