清华谭旭研究组合作发文报道体内靶向基因治疗新方法
来源:清华新闻网
自上世纪90年代以来,基因治疗逐渐兴起,其通过补偿基因缺陷或修正异常致病基因从而达到治疗的目的。CRISPR是在细菌中发现的一种DNA剪编辑系统,由于其高效特异的DNA剪切和编辑能力在科研领域已经得到广泛应用,而在临床治疗中其应用前景也非常值得期待。已有的CRISPR体内输送是通过运用腺病毒表达体系来表达Cas9和sgRNA,就像腺病毒在基因治疗历史中的巨大作用一样,但也存在诸如腺病毒缺乏靶向性,本身免疫源性较高,病毒在体内有一定重组突变机率等问题。而且,腺病毒在细胞内的长期稳定表达Cas9 蛋白,也有可能带来长期的毒副作用。
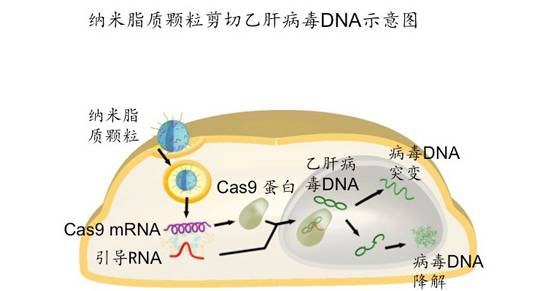
基于脂质纳米颗粒的核酸输送系统已经在活体内输送小RNA,如siRNA上表现出良好的效果。谭旭研究组合作研发了一种新型脂质纳米颗粒系统,可以包裹Cas9蛋白的mRNA以及单链引导RNA,并在活体内有效的输送至肝脏并进行表达,对特定致病基因进行切割。
为测试所研发的新型脂质纳米颗粒系统的实际效果,研究组分别选取了以下一个外源性靶点和一个内源性靶点进行测试。选择的外源性靶点是乙肝病毒(HBV)基因组。全球乙肝病毒感染者约有3.5亿人,而在中国,乙肝病毒携带也是一个严重的社会问题。乙肝病毒难以彻底清除的主要原因是其基因组以一种共价闭环DNA(covalently closed circular DNA或cccDNA)形式存在,而现有治疗手段均无法触及cccDNA;选择的内源性靶点是前蛋白转化酶枯草溶菌素9(Proprotein convertase subtilisin/kexin type 9, PCSK9)是当前针对高胆固醇血症和其它心血管疾病药物研发的重要靶点。就目前来看,针对PCSK9的药物主要是抗体类药物,需要长期多次服用,价格昂贵。上述二者均有希望通过编辑其基因序列而达到治疗的目的,故研究组选取此二者为对象,测试这种新型的药物递送系统。
研究发现在细胞水平上,经这种新型脂质纳米颗粒(LNP)包裹的Cas9/sgRNA,能够有效的对细胞中HBV cccDNA和Pcsk9基因进行切割,并有效的降低HBV相关抗原的表达。动物实验结果表明,这种新型脂质纳米颗粒可以有效递送Cas9/sgRNA输送至肝脏进行表达,并且尾静脉注射6小时后Cas9蛋白表达量达到最大,其后逐步降低,24小时后消失。在肝脏内,所递送的Cas9/sgRNA能对内外源基因序列进行有效的特异性剪切,进而降低相关蛋白的表达量。一次注射能有效降低乙肝病毒表达量50%以上。国际审稿人认为这项工作是本领域激动人心的成果,对CRISPR/Cas9系统未来的临床转化研究有重要意义。
论文通讯作者为谭旭和董一洲。清华大学生命科学学院博士生蒋超、梅淼,俄亥俄州大学博士后李斌、清华大学医学院博士生朱修锐为共同第一作者。清华大学生物医学工程系的郭永课题组也有重要贡献。该工作得到了科技部重点研发计划,中组部青年千人计划,生命科学联合中心和美国盖茨基金会的资助。










