如何通过修复基因来治疗疾病
今天读了浙大王立铭教授写的《上帝的手术刀:基因编辑简史》。这是一本科普读物,主要是介绍基因的相关知识,包括基因如何被发现、基因如何治病基本、基因工程未来的应用前景等。
说到基因,现代人几乎无人不晓。首先基因是存在于细胞中的遗传物质。基因(遗传因子)是产生一条多肽链或功能RNA所需的全部核苷酸序列。生物体的生、长、衰、病、老、死等一切生命现象都与基因有关。带有遗传讯息的DNA片段称为基因,其他的DNA序列,有些直接以自身构造发挥作用,有些则参与调控遗传讯息的表现。
在2003年“人类基因组计划”完成后,关于我们自身的遗传秘密也已经一览无余。既然基因控制着我们身体的方方面面,那么和肥胖有没有关系?和近视眼有没有关系?和身高有没有关系?和皮肤有没有关系?……
回答是:有!有!有!有!……
看到这里,很多读者特别是女读者立刻瞳孔放大:真的能通过改变基因来实现怎么吃都不长肥的?真的能通过改变基因来实现皮肤的雪白光洁,弹指可破?
理论上是可以的!
“快告诉我在哪里有?这药多少钱一包?”女生们都打开了支付宝准备付款了。
不要着急,听我慢慢说。
早在1963年,就在著名的DNA双螺旋模型获得诺贝尔奖之后仅仅一年,分子生物学家约书亚・莱德伯格(Joshua Lederberg)就已经乐观地预言:“通过修改人体基因来治疗疾病,将仅仅是个时间问题”。此中蕴含的道理是不言而喻的:既然基因对于生物——当然也包括人类——的性状是如此重要,那么形形色色的人类疾病也一定会和基因的错误密切相关。既然如此,通过修改基因出现的错误来治疗疾病不就是顺理成章、釜底抽薪的办法吗?
我们先看看医生有没有成功过呢?
答案是:有的。
1990年2月,在经过烦琐细致的文件审查和长达20小时的公开听证会答辩后,经由美国食品和药品管理局批准,美国国家卫生院的威廉・安德森医生正式开展了针对重症联合免疫缺陷病的基因治疗。很快,安德森医生就遇到了4岁的小女孩阿香提・德希尔瓦和她焦虑的父母。
和所有重症联合免疫缺陷病的患者一样,德希尔瓦的免疫功能几乎被完全摧毁了。从出生起,她就遭受着无休止的耳道感染、肺部感染和鼻腔感染的困扰。4岁的她身高体重都只有正常2岁孩子的水平。客观来说,即便是在20世纪80年代,重症联合免疫缺陷病也还是有治疗方法的:一就是定期注射腺苷脱氨酶蛋白;另一种是骨髓移植,为患者注入能够正常合成腺苷脱氨酶的免疫细胞。然而两种方法都失效了:小德希尔瓦对腺苷脱氨酶注射失去了反应,同时她的医生根本找不到合适的骨髓配型用于治疗。
于是就像人类医学史上许多里程碑式的事件一样,德希尔瓦的父母在绝望中做出了无奈选择,让他们不幸的女儿接受未知命运的挑战,尝试一种前所未有的科学冒险。
1990年9月,在长达12天的治疗周期中,安德森医生和其他合作者首先从小病人的体内抽取大量血液,提取其中的白细胞,然后再将功能正常的腺苷脱氨酶导入这些细胞中。到了9月14日下午12:52,医生们用颤抖的双手打开阀门,把经过基因改造后的白细胞重新输回小病人体内。在手术后的检查中,医生们证明,德希尔瓦体内的白细胞重新生产出了氨基酸序列正常的腺苷脱氨酶!于是,在混沌初开之后的自然历史上,第一次有智慧生物开始从造物主的视角,挑战进化带给自身的病痛折磨。
几个月之后的1991年,第二位罹患重症联合免疫缺陷病的11岁女孩辛迪・凯西克(Cindy Kisik,见图2-10)在同一家医院接受了安德森医生的基因治疗。手术同样取得了成功。
到了1992年底,美国密歇根大学医学中心的詹姆斯・威尔逊(James Wilson)医生宣布,他的团队成功治疗了一名患有家族性高胆固醇血症的29岁女性。威尔逊发现,在手术后的数月之内,患者体内的胆固醇水平得到了显著控制。完全不同的患病基因,完全不同的人类疾病,同时也是完全不同的技术路线,然而基因疗法又一次成功了。
作为基因治疗技术的最早受益者,德希尔瓦和凯西克都顽强地活了下来。2013年,她们一同参加了美国免疫缺陷基金会的年度会议,并且和当年实施手术的迈克尔・布莱西(Michael Blaese)医生合影。亲手开创基因治疗时代的安德森医生本人并没有出现在这张历史性的合影里。他在2007年因性侵一名少女锒铛入狱,至今仍在服刑。
此后,众多患者、医生和科学家的热情被迅速点燃,临床试验在美国、欧洲、中国和南美的许多医学机构中被迅速设计出来并开展实施。仅仅在美国国家卫生院,安德森医生开展第一例基因治疗手术的地方,在随后的10年间就批准了数百例基因治疗。截至2000年,全世界开展了超过500个基因治疗临床试验,超过4 000名患者参与其中,相关疾病也在不断扩展。许多人真诚地相信,基因治疗的时代到来了。
上面的故事里,病人的治疗是成功的,但是安德森医生到底是怎么把腺苷脱氨酶基因重新引入德希尔瓦体内的呢?
魔鬼藏在细节里。
说到这里,我们这里先要给大家泼一瓢冷水了,我们现在的研究发现:并非单一的基因控制着我们身体上的性状。比如,我们就发现肥胖就和很多基因组以及外界环境有关。包括很多癌症,医生现在也很难确定是哪一组基因导致了哪一种癌症,即使是基因很相近的情况(比如孪生兄弟和姐妹),也会有不同的结果。
而且,大家想想基因是存在于细胞里的,两个问题:一个是体积非常小,另一个是数量非常多,我们怎么去改变这些基因呢?
用手术刀一个一个挖出来放到显微镜下改?这是不可能的。用化学药物?我们知道一般的化学药物很能作用到细胞内部,而且还要精准定位到DNA上,这也不可能。
那么怎么办呢?
用病毒!
对的,你没有看错,就是用病毒!
说到病毒,大家马上就想到该死的感冒病毒,HIV艾丝病病毒……
现在有谁愿意用病毒来改变自己的基因?
简单的说就是将特定的人体细胞从体内取出,利用病毒工具将DNA片段送入细胞内,再将接受过基因编辑、部分恢复正常机能的细胞送入人体。其实科学家和医生只是利用病毒作为基因治疗的“搬运工”,将特定的DNA序列引入人体细胞中。
为什么病毒可以担此重任呢?
下面要来聊一聊病毒。
病毒是地球上最微小的生命。绝大多数病毒颗粒的直径都不会超过300纳米,上千个病毒颗粒堆起来的大小还比不上我们常说的“微生物”细菌。在这么小的尺寸里安置一个有机生命是一件异常困难的任务,所以漫长的进化史中留下的是极简和最优化的生命设计蓝图。
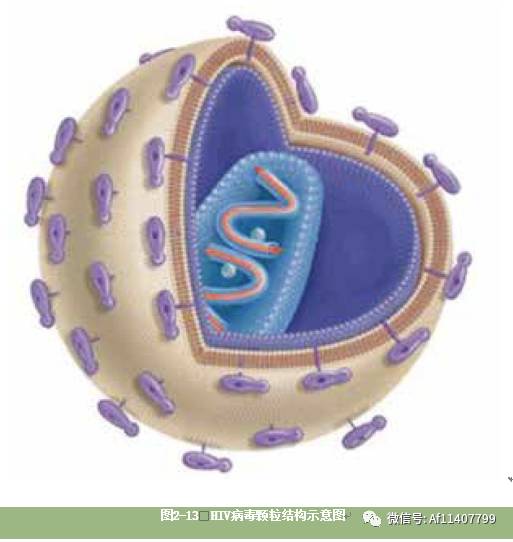
绝大多数病毒的结构都非常简单,外层是由蛋白质颗粒紧密连接形成的空心球状外壳,坚硬的外壳内部保护着病毒的遗传物质。有的时候,病毒最外面还会包裹着一层薄薄的脂质分子。不过,不同于细菌、豌豆和人类总是用DNA双链螺旋来储存遗传信息,病毒的遗传物质复杂多变,可以是双链DNA,也可以是单链DNA,甚至还可以干脆就是RNA。但在区区几百纳米的空间里,DNA或RNA序列所能携带的遗传信息是非常有限的。举例来说,流感病毒拥有11个基因,HIV仅拥有9个基因。
病毒的生活史可以被分成截然不同的两个阶段。在无机环境中的病毒颗粒其实可以被当作非生命来对待,比如空气中、土壤里、水里的流感病毒或HIV颗粒,本身无法进行任何新陈代谢和生殖繁衍。如果保存条件合适,这些病毒颗粒可以千秋万代地稳定存在下去,就像我们身边的石头。只有进入到其他生物的细胞内之后,病毒才会借助宿主细胞本身的大量基因,开启自己专属的生命活动。连复制自身基因、繁衍后代的活计,病毒也都需要宿主的“帮忙”。病毒是真正字面意义上的寄生虫。
以我们反复提到的HIV为例,这种病毒其貌不扬,看起来就是一个直径120纳米左右的球体。这个球体的最外层包裹着一层薄薄的脂质分子(接下来你会明白这层脂质分子从何而来)。脂质层上镶嵌着几个病毒自身制造的蛋白质分子。脂质层下方是致密的病毒壳体,壳体内部包裹着两条单链RNA分子和另外几种病毒自身制造的蛋白质。病毒的所有9个基因就定位在这两条单链RNA分子上。
最外层黄色的是脂质分子层,上面还插着紫色的病毒蛋白,这些蛋白将会帮助HIV找到它们的“家”,也就是人体的免疫细胞。脂质分子层内包裹着蓝色的病毒蛋白质外壳和红色的病毒单链RNA分子。
很多读者早已知道,HIV的“专属”宿主细胞,是某一类特别的人体免疫细胞。当HIV从休眠状态中醒来时,HIV脂质外层上的蛋白质能够特异性地和人体免疫细胞表面的几个蛋白质相结合,从而准确地为HIV找到可以栖身的宿主。当HIV精确定位到人体免疫细胞表面后,HIV的脂质外膜就会和人体细胞的脂质外膜融为一体,就像两个肥皂泡融合成为一个更大的肥皂泡一样。HIV病毒颗粒内部的蛋白质和RNA分子就得以从容地进入人体细胞内部。之后,在一系列复杂的生化反应中,以病毒的RNA分子为模板,一条碱基序列和与之精确互补的DNA分子会被生产出来,被运送到免疫细胞的深处,插入人体细胞的基因组DNA长链之上。
在上述步骤完成之后,就可以说HIV已经成为人体免疫细胞的一部分了。每一次免疫细胞复制的时候,都会依样画葫芦地帮助HIV也复制一套专属于它的遗传物质。如果HIV启动它的繁衍程序时,它就可以利用隐藏在人体基因组DNA深处的遗传信息,让人体细胞为它合成病毒的各种必需蛋白质,为它准备病毒颗粒的RNA遗传物质,甚至让人体细胞为它们组装出完整的病毒颗粒来!一旦时机成熟,这些病毒颗粒就会在细胞膜上“顶”出一个小鼓包,然后裹着一团人体细胞的细胞膜呼啸而去,留下千疮百孔的免疫细胞。看到这里,你应该明白为什么HIV能够破坏人体的免疫机能。
你是不是已经意识到了些什么?没错。能置人于死地的HIV,似乎恰好能够满足向特定细胞运输特定基因的需要啊!HIV脂质外层上镶嵌的蛋白颗粒能精确定位人体的免疫细胞,HIV也能够将自身的遗传信息有机整合在人体细胞的基因组DNA之上。那么,如果有一个办法能够把腺苷脱氨酶基因放入HIV的单链RNA分子内,不就可以用HIV帮助我们入侵重症联合免疫缺陷病患者的免疫细胞,帮助我们将救命的腺苷脱氨酶基因片段一劳永逸地插入患病细胞的基因组,帮助患者的免疫细胞开始源源不断地生产具备正常功能的腺苷脱氨酶了吗?
故事讲到这里,基因疗法的缺环几乎都被补上了。1990年安德森医生开展的历史性试验,几乎就是我们刚刚描述过的样子。
当然了,会导致艾滋病的HIV还是太过危险了。最终科学家们选定的是一种名为莫罗尼小鼠白血病病毒(moloneymurine leukemia virus)的家伙。这种病毒能够高效侵染啮齿类动物的淋巴细胞并导致白血病,但对人类淋巴细胞的侵染能力和致病性,相对来说就要好控制得多。
不仅如此,为了保证更好的安全性,安德森医生还在1985年进一步改造了莫罗尼小鼠白血病病毒。他和其他合作者把莫罗尼小鼠白血病病毒中编码外壳蛋白的基因序列统统删掉了。这样一来,实验室生产出的莫罗尼小鼠白血病病毒固然可以定位和进入人体细胞,但是之后根据其携带的遗传信息制造出的病毒后代就再也不能制造出完整的外壳,也就再也无法组装出新一代的病毒颗粒了。这样就可以防止病毒自身在人体细胞里无休止地疯狂繁衍。它们被授权的任务只有一个,进入人体细胞,释放出科学家和医生们希望病人重新获得的遗传物质。
此后发生的一切我们已经很熟悉了:1990年的第一次人体试验、德希尔瓦和凯西克的康复、基因治疗时代的“开端”、世界各地的基因治疗狂热,以及狂热之后的一地鸡毛。
那时候人们不知道的是,除了运输基因的天才本领,病毒还会在人体内悄悄地做很多事情。
1999年9月17日,18岁的亚利桑那男孩杰西・基辛格(Jesse Gelsinger,见图2-15)在美国宾夕法尼亚大学参加一项基因治疗临床试验时不幸去世。
基辛格在出生后就小病不断。不仅如此,他的父母还发现他很不喜欢食用牛奶和肉类,只喜欢吃马铃薯等富含淀粉的食物。2岁时,基辛格被诊断出患有罕见遗传病——鸟氨酸氨甲酰基转移酶缺乏症(ornithine transcarbamylase defciency, OTCD)。简单来说,这种单基因遗传病破坏了基辛格的身体代谢和利用蛋白质的能力。如果蛋白质吃得太多,他的身体里将会迅速积累大量氨分子——一种蛋白质代谢的副产品,从而危及生命。
依靠对蛋白质摄入的严格控制和全面的药物治疗,基辛格还算是磕磕绊绊地长大成人了。但进入青春期的他开始对自己与生俱来的恼人疾病、日夜不断的服药(严重时他甚至需要每天服用50片药片),以及一年到头不断地需要因为这样或那样的意外情况住院治疗感到厌烦。与此同时,一直照顾他生活的父亲面对月复一月的高额医疗账单也一筹莫展。他的父亲离婚又再婚,需要照顾两个家庭6个孩子的压力可想而知。
1999年6月,基辛格高中毕业,一家人利用暑假前往纽约的伯父家度假。假期结束后,基辛格独自前往位于费城的宾夕法尼亚大学,正式签订了参加临床试验的知情同意书。他被告知,他将要参加的仅仅是最早期的临床试验。在此试验期间,医生们将要为他注射没有携带任何救命基因的“空”病毒,这种病毒载体内并没有救命的鸟氨酸氨甲酰基转移酶基因。试验的目的仅仅是为了检验整个流程——从病毒制作到输入人体——的安全性。真正检验治疗效果的试验尚未开展,但基辛格最终还是决定加入。
就在接受病毒注射的9月13日当晚,基辛格便陷入高烧和深度昏迷。在几天之内,他的多个脏器出现严重衰竭。9月17日,基辛格被宣布脑死亡。年轻的他还没有来得及说出任何感受。
直到此时,科学家和医生们才如梦初醒。在长达10年的时间里,他们被基因治疗的狂热蒙蔽了双眼。他们梦想着用这种方法攻克一个又一个的顽固遗传疾病,他们被病毒传输DNA的神奇能力所折服,却忽略了一个人们早就知道的问题:当我们的身体发现病毒之后,会作何反应?
当病毒侵入人体之后,人体的免疫系统会迅速识别病毒,释放出大量“杀伤性武器”,一种名为细胞因子的蛋白质会进入被病毒侵染的组织,这些细胞因子吹响了抵御病毒入侵的号角。它们能迅速扩张血管、增强血管通透性、提高组织温度,引导专一杀伤病原体的免疫细胞大军进入该区域。而进入该区域的免疫细胞还会进一步释放更多的细胞因子,把战斗的号角吹得更加嘹亮。因此,在短时间内人体就可以有效地在被感染部位募集巨量免疫细胞,对病毒颗粒形成围攻态势。
可以想象,迅速聚集的细胞因子和免疫细胞必须得到妥善的“分流”和“降温”,否则它们所蕴含的巨大破坏力将会转而杀伤人体本身的细胞和组织,“入侵者”和“良民”将会玉石俱焚。实际上,许多感染性疾病之所以凶险致命,并不是因为病毒本身,而是因为人体免疫系统对病毒的剧烈反应。大家可能都很熟悉的H5N1型禽流感正是这样一个例子。H5N1禽流感病毒可以在人体肺部引发爆炸式的免疫反应。短时间内,上百种细胞因子在肺部集中释放,造成肺部乃至全身器官的功能衰竭,这也是H5N1禽流感高致死率的原因所在。
2003年,另一场悲剧又一次沉重打击了基因治疗领域,将拥护者们残存的乐观情绪冲击得灰飞烟灭。一份来自伦敦和巴黎的报告声称,有5名正在接受基因治疗的儿童患上了白血病!
我们已经讲过,安德森医生在1990年使用的病毒载体——莫罗尼小鼠白血病病毒,是一种逆转录病毒。它所携带的遗传物质是单链RNA分子,在进入人体细胞后,需要先“逆转录”成DNA分子,插入人体基因组DNA,才可以长期稳定地存在于人体细胞内。这个特性无疑正是安德森医生选中该病毒的原因之一。
然而,一个长久以来被有意无意忽略掉的技术细节是,当外源基因插入人体基因组DNA的时候,它究竟会插到什么位置上去?我们已经知道,人类基因组DNA上也保存着关于我们每个人的遗传密码:身高、长相、血型、个性、智力,以及对各种疾病的易感性和抵抗力。
因此,我们很容易想象,如果外源基因碰巧插入了人类基因组的重要区域,破坏了某个负责重要功能的基因,就有可能导致严重的疾病。事实上,这种用于基因治疗的莫罗尼小鼠白血病病毒本身,之所以被命名为当前的名字,就是因为当它入侵小鼠时会碰巧插入小鼠基因组DNA上一个名为Bmi-1的基因,从而诱发小鼠患上白血病。当这个病毒被用于人体基因治疗时,它有可能插入和破坏一个名为LMO2的人类基因,而这个基因的异常激活和人类白血病密切相关。更要命的是,欧洲的医生们直接在患者的骨髓干细胞上动手,进一步强化了这种威胁!与血液中的白细胞不同,骨髓干细胞可以终身存活并持续不断地分裂产生白细胞后代。因此,骨髓干细胞的癌化会持续产生变异的白细胞,从而导致白血病。
对病毒载体的不断优化和改良也在世界各地的实验室里不间断进行着。科学家们首先改进了之前使用的莫罗尼小鼠白血病病毒,使其影响人类基因功能的可能性大大降低。与此同时,鉴于以莫罗尼小鼠白血病病毒为代表的逆转录病毒,在整合插入人类基因组时或多或少具备某些危险的专一性,无形中提高了它们诱导癌症的概率,科学家们把目光转向了其他种类的病毒。
2012年,在两次悲剧打击下艰难复苏的基因治疗领域,终于迎来了第一个真正通过严苛的临床试验,进入市场的产品——Glybera。这种基因治疗药物用于治疗一种发病率仅有百万分之一的单基因遗传病——脂蛋白脂肪酶缺乏症。这种药物利用了一种新的病毒载体腺相关病毒(adeno-associated virus, AAV),将人类脂蛋白脂肪酶基因LPL重新放回患者的肌肉细胞内。在此之后,又有数个基因治疗产品迎着人们怀疑的目光,通过了安全性和疗效方面的严苛考验。2016年,有2 000多个基因治疗的临床试验在全球范围内同时展开。这个曾经被很多人寄予厚望,又被许多人宣判死刑的领域,又重新活了过来。
有史以来第一个正式上市的基因治疗药物,用于治疗极其罕见的脂蛋白脂肪酶缺乏症。这种药物于2012年上市,使用成本高达每人110万欧元,可能是现在世界上最昂贵的药物。
感谢科学的进步,感谢人类对基因、遗传病、病毒载体以及对免疫系统更深刻的理解,也感谢历次基因治疗的悲剧带来的教训,基因治疗重新开始了其漫漫征程。
今天的内容,终于解决困扰我多年的问题:基因那么小,如何去改变?原来是利用病毒当“运输工人”。
可能大家又要问了,你这说的只是治病,有没有改造基因的可能?也是有的,这是我们下次要谈的话题:基因的编程时代会给我们带来什么?敬请期待吧……