基因疗法3期临床公布数据,有望持久治疗血液病
▎药明康德/报道
bluebird bio公司近日宣布了名为Northstar-2(HGB-207)的3期临床试验早期数据。该研究是为了检验LentiGlobin基因疗法在输血依赖性β型地中海贫血 (Transfusion-dependent-β-thalassemia,TDT)患者体内的安全性和有效性。这些数据由加州大学旧金山分校(University of California, San Francisco)的Mark Walters博士在6月25日西班牙马德里举行的欧洲血液学协会(EHA)年会上公布。
TDT也称为重型β型地中海贫血症(β-thalassemia major)或是Cooley’s anemia,是一种遗传性血液疾病。如果没有得到及时治疗,在生命的最初几年可导致死亡。尽管对疾病的常规控管取得了进展,包括终生频繁输血和铁螯合疗法,但仍有很多重大的医疗需求并未得到满足,例如严重发病和早期死亡的风险。目前,治疗TDT的唯一的先进疗法是异体造血干细胞移植(HSCT)。HSCT的并发症包括由治疗而导致的死亡、移植物衰竭、移植物抗宿主疾病和机会性感染的重大风险,特别是由非直系血亲匹配的HSCT。
Northstar-2(HGB-207)是一个持续,开发标签,单剂量,全球性,多中心的3期临床试验,旨在评估LentiGlobin基因疗法对TBT患者的安全性和有效性。该研究计划入组15名成人和青少年患者,然后再接受8名儿童患者进行扩展研究。这项研究的主要终点是接受治疗的受试者达到“输血不依赖“的比例,该标准定义为在研究期间连续12个月不进行任何输血的前提下,患者体内总血红蛋白水平至少达到9g/dL。
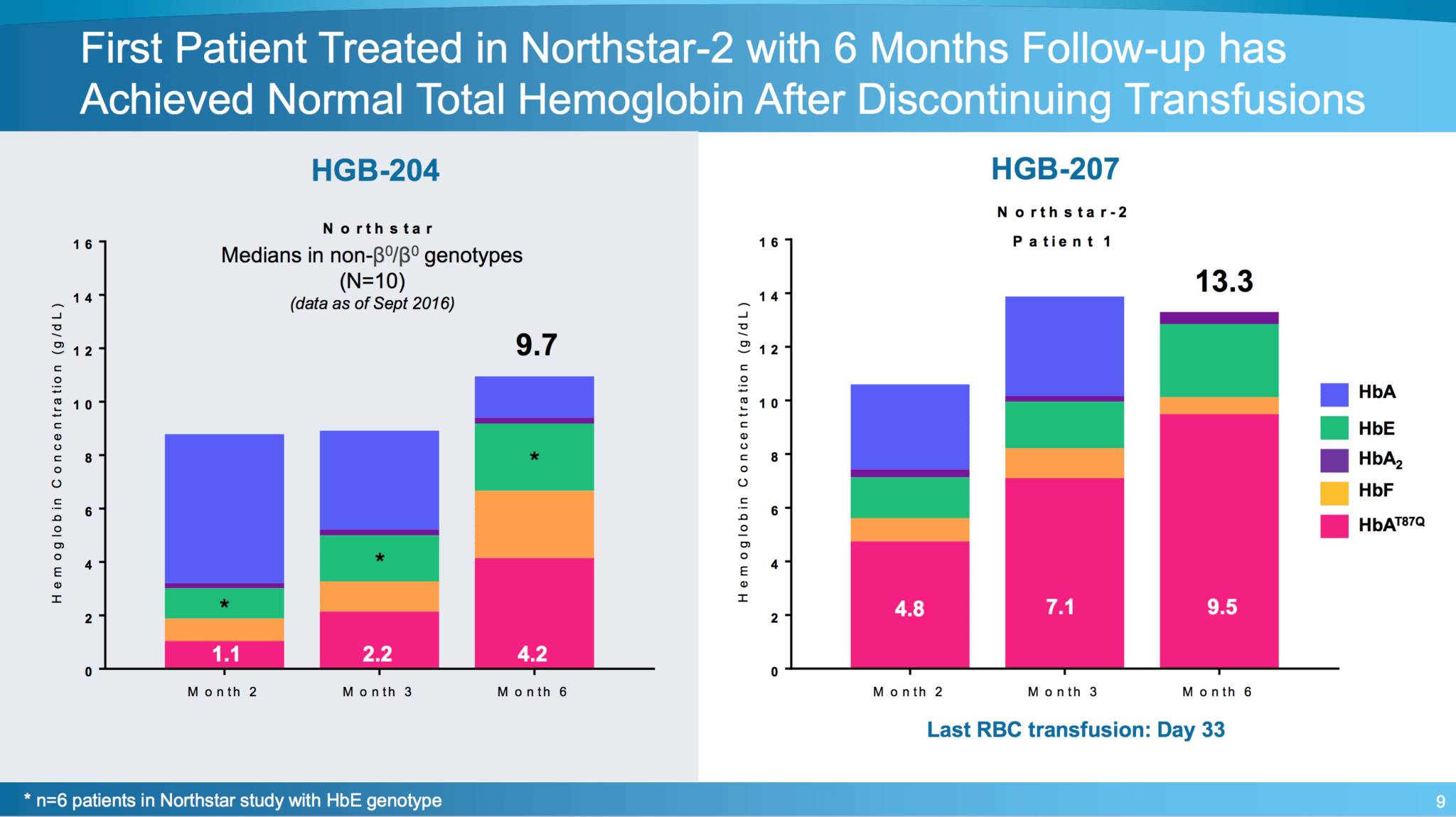
▲HGB-207试验中前三例患者的响应数据(图片来源:bluebird bio官网)
该3期临床研究在前三个TDT患者身上获得了人体上使用基因疗法的可能性数据,该基因疗法通过载体转入修正基因,使患者自身生成健康的红血球蛋白来对抗疾病。截止6月2日的数据显示,第一例患者治疗后一个月停止输血,治疗后六个月体内总血红蛋白含量仍在正常水平。另外的两名患者显示了类似的成功潜力——虽然其中一名患者疗效也呈阳性,但是他体内的载体阳性细胞数量比其他两位患者要低。bluebird bio的高管希望也能达到持久疗效。
▲bluebird bio在EHA上公布的HGB-207试验在第一例患者的响应数据,与生产工艺改进前(HGB-204)对比(图片来源:endpts.com)
在这项研究中,药品生产工艺的提高使得病毒载体数和细胞转导成功率得到增加。 “Northstar-2是我们第一个利用改进LentiGlobin药品生产工艺来增加药物载体拷贝数(vector copy numbers,VCN)和细胞转导率的研究。这项研究的第一个病人在治疗后一个月便可以停止输血,并在治疗后六个月血红蛋白值达到了一个正常水平,” bluebird bio的首席医学官David Davidson博士说:“这些早期结果表明,通过改进药品生产工艺来增加药物载体拷贝数和慢病毒载体阳性(LVV +)细胞,这与HbAT87Q的高产量相关,最终可能解决已知的患者间疗效差异问题。”
“尽管现在还早,这些数据和越来越多的临床证据表明,LentiGlobin可以为TDT患者带来一种革命性的好处,” 这项研究的主要研究者,芝加哥Ann & Robert H. Lurie儿童医院的Alexis Thompson博士说:“TDT的患者依赖于循环式的输血和螯合疗法,对这些患者来说,LentiGlobin基因疗法可以提供一种一次性的长期解决方案,减轻当前治疗引起的许多并发症。”
参考资料:
[1] Bluebird bio steps up with a promising snapshot of its gene therapy upgrade
[2] Bluebird Bio’s gene therapy for blood disorders yields some impressive results ― but also raises questions
[3] Bluebird bio Announces Early Data from Phase 3 Northstar-2 (HGB-207) Study of LentiGlobinTM Drug Product at European Hematology Association (EHA) Annual Meeting