浅谈基因突变对免疫治疗的影响
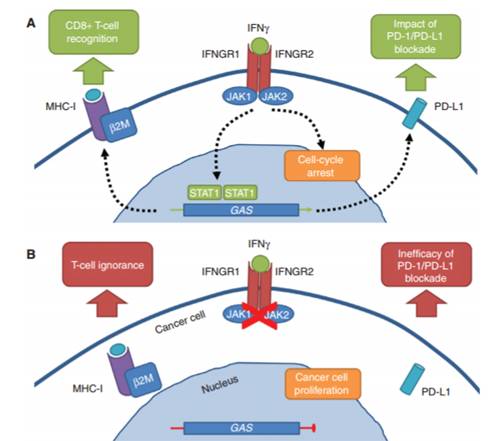
随着基因检测服务的不断完善,基因检测对靶向治疗的指导作用得到患者、临床医生和科研人员的普遍认可。而以PD-1/PD –L1抑制剂为代表的免疫治疗是当前全世界备受瞩目的肿瘤治疗新方案,被誉为抗癌历史的第三次革命。基因检测得到的基因突变对免疫治疗又有什么样的影响呢? 这里要说的第一类基因突变是与DNA修复系统相关的基因突变。 目前,已知一些基因突变特别是DNA修复信号通路相关基因的突变会导致较高的肿瘤突变负荷。而具有较高肿瘤突变负荷(tumor mutation burden, TMB)的患者,更容易从PD-1/PD-L1抑制剂中获益。2017年4月AACR大会上,BMS公司对CheckMate 026三期临床试验进行回顾性研究,结果显示,相比PD-L1的5%阳性表达,选择TMB作为Opdivo治疗NSCLC的标志物,能更好地区分获益人群。该研究发现,在TMB高表达的病人中,采用Opdivo进行治疗后,ORR(客观缓解率47% vs. 28%)和PFS(无进展生存期,9.7月vs. 5.8月)结果显著优于化疗。 图1 肿瘤突变负荷与免疫治疗获益的关系 DNA错配修复基因(Mismatch Repair, MMR)MLH1、MSH2、PMS2、MSH6等基因突变不仅引起微卫星不稳定性(Microsatellite instability, MSI),也会导致产生更多的体细胞突变(P = 0.007)。DNA错配修复缺陷(MMR)或者微卫星高不稳定性(MSI-H)更能够从派姆单抗(pembrolizumab)的免疫治疗中获益(PMID: 26559582)。今年5月,美国FDA批准派姆单抗用于MSI-H/dMMR实体瘤患者。这是FDA首次批准不以肿瘤部位为参考,仅依靠生物标志物进行治疗选择的突破。 POLD1和POLE是DNA复制过程中的具有外切酶校正功能的蛋白。这两个基因突变发生后会引起非同义突变负荷、新抗原负荷以及TIL数量的上升(PMID: 26181000 ),此类患者也更容易从PD-1免疫治疗中获益。 BRCA1和BRCA2在DNA重组和双链断裂修复过程发挥着重要的作用。研究表明这两个基因的突变导致较高的肿瘤突变负荷和新抗原负荷、PD-1/PD-L1表达上升、CD3+和CD8+的TIL细胞显著增加,因而也表现出对PD-1/PD–L1抑制剂更为敏感(PMID: 26871470)。 不仅如此,事实上,更多的DNA修复相关基因如PRKDC、LIG3、RAD17、RAD51C、FANCF、ERCC1等众多的基因突变在肿瘤中被检测到。而发生这些基因突变的肿瘤,一般具有较高的非同义突变负荷,客观反应率上升,获得更持久的临床效益和无进展生存期(PMID: 25765070、PMID: 27390348)。 第二类要说的基因突变是对肿瘤发生发展具有促进作用的驱动基因突变 与免疫治疗疗效正相关的基因突变被研究的越来越多,也给患者和临床医生的治疗方案带来积极的指导。但是,与免疫治疗疗效负相关的一些基因突变同样值得关注。来自美国加州大学圣地亚哥分校穆尔斯癌症中心的科学家们发现,5例发生MDM2/MDM4基因扩增的肿瘤患者,单独使用PD-1/PD–L1抑制剂后,短时间内(<2个月)肿瘤发生爆发性的进展;8例发生EGFR基因扩增或者激活性基因突变的肿瘤患者,以及4例发生DNMT3A基因突变的肿瘤患者,短时间内(<2个月)肿瘤同样发生了显著性的进展(PMID: 28351930)。 CheckMate 142研究表明具有KRAS或BRAF的结直肠癌患者,比野生型的患者对纳武单抗的客观反应率(ORR)要低(27% vs. 41%)。在非小细胞肺癌中,具有EGFR基因突变或者ALK基因重排的患者,对PD-1/PD–L1抑制剂的客观反应率(ORR)也要低(3.6% vs. 23.3%)。发生KRAS突变的患者,其PD-L1、IFN-γ、STAT1的表达水平比野生型的要低;但是如果同时发生KRAS突变和TP53突变,使用PD-1/PD –L1抑制剂的效果较野生型要好。 图2 肺癌驱动基因突变与免疫治疗获益的关系 在小编看来,如果患者检测到靶向药物相关的基因突变,应当考虑靶向治疗,其疗效一般不会比免疫治疗差。不过,对于这类驱动基因突变与免疫治疗的相关性不宜过早地下结论,还有待于大样本量案例或临床试验的验证。例如有案例报告一例发生EGFR突变的肺癌患者从纳武单抗(Nivolumab)的治疗中获益。该患者检测到TP53基因R249S和EGFR基因L858R的肿瘤驱动突变(PMID: 28649487)。 也有综述文章(PMID: 8187290)总结这种PD-1/PD –L1抑制剂的耐药性机制包括:1)具有KRAS或BRAF等MAPK信号通路的激活性基因突变;2)PTEN基因缺失引起的PI3K信号通路增强;3)WNT/β-catenin信号通路的表达;4)上皮间质细胞转化(EMT)的基因表达上调;5)细胞粘连、细胞外基质重建、血管生成的基因表达上调等。 第三类要说的基因突变是γ-干扰素信号通路的基因突变。 γ-干扰素(IFN-γ)是细胞因子超家族中IFN家族的重要成员,具有抗病毒、抗肿瘤及免疫调节等多种生物学功能。IFN-γ一般由肿瘤中的效应T细胞或者是抗原呈递细胞呈递抗原时产生,并且募集其他免疫细胞,从而启动抗肿瘤增殖和引起肿瘤的凋亡效应,因此γ-干扰素信号通路处于抗肿瘤的中心位置。干扰素信号通路基因发生突变预示对免疫治疗不敏感。 携带JAK1或JAK2基因突变的患者很大可能原发耐药(PMID: 27903500),这些患者即使具有较高的突变负荷,即使是DNA错配修复系统缺陷,仍然对PD-1/PD –L1抑制剂不响应。在此前发表在NEJM上的一项研究中(PMID: 27433843),研究人员分析了免疫治疗之前以及肿瘤复发后的肿瘤组织,他们发现其中的一个肿瘤缺少一种叫做B2M的基因,这会导致JAK1/2的信号无法正常发挥作用。 图3 γ-干扰素信号通路基因突变与免疫逃逸 CRISPR的大牛张锋教授参与的研究(PMID: 28783722)找到了一个新的会影响免疫疗法的基因APLNR。APLNR通过与JAK1蛋白结合,从而调节肿瘤对干扰素-γ的响应。如果它失去功能,就会降低免疫疗法的效果。与之相对应,如果过量表达APLNR,就能显著增强肿瘤细胞对T细胞攻击的敏感度。肿瘤细胞的细胞溶解率也从71.7%上升到了81.1%。 事实上,干扰素信号通路的其他基因包括干扰素受体基因(IFNGR1、IFNGR2)、抗原呈递相关基因(TAP、HLAs)的突变,均可能导致肿瘤细胞的免疫逃逸,从而表现出对免疫检查点抑制剂药物的耐药性。