关于基因编辑,你还知道些什么?
贝壳社微信号:iBio4P本文由贝壳社布拉德皮蛋编译。转载请注明来源:贝壳社(微信号:iBio4P)。
最近,一条新闻刷爆朋友圈:英国利用基因编辑技术成功治愈了一位身患白血病的小女孩。而在此之前,中国年仅29岁的女科学家杨璐菡利用基因编辑技术敲除基因猪基因组中可能有害的病毒基因,扫清猪器官用于人体移植的重大难关更是引起了科学界的轰动。
基因组编辑技术(genome editing)是一种可以在基因组水平上对DNA序列进行改造的遗传操作技术。这种技术的原理是构建一个人工内切酶,在预定的基因组位置切断DNA,切断的DNA在被细胞内的DNA修复系统修复过程中会产生突变,从而达到定点改造基因组的目的。
与射线或化学诱变剂导致的DNA 随机突变不同的是,基因编辑技术是定向改变基因的组成和结构,具有高效、可控和定向操作的特点。因此,基因编辑技术被麻省理工科技评论评为 2014 年十大突破性科学技术,其中 CRISPR 还获得了被称为“豪华版诺贝尔奖”的2015 年度“生命科学突破奖”。
基因编辑技术可实现三种基因组改造
虽然各种基因编辑技术的原理及作用方式并不相同,但它们的共同之处是基因编辑都建立在使目标基因DNA 产生双链断裂(Double Strand Breaking, DSB)的基础上。而DNA修复系统主要通过两种途径修复DNA双链断裂(double-strandbreak,DSB),即非同源末端连接(Nonhomologous end joining, NHEJ)和同源重组(homologousrecombination, HR)。通过这两种修复途径,基因组编辑技术可以实现三种基因组改造的目的,即基因敲除,特异突变的引入和定点转基因。
基因敲除:如果想使某个基因的功能丧失,可以在这个基因上产生DSB,NHEJ修复的过程中往往会产生DNA的插入或删除(indel),造成移码突变,从而实现基因敲除。
特异突变引入:如果想把某个特异的突变引入到基因组上,需要通过同源重组来实现,这时候要提供一个含有特异突变同源模版。正常情况下同源重组效率非常低,而在这个位点产生DSB会极大的提高重组效率,从而实现特异突变的引入。
定点转基因:与特异突变引入的原理一样,在同源模版中间加入一个转基因,这个转基因在DSB修复过程中会被拷贝到基因组中,从而实现定点转基因。通过定点转基因的方法可以把基因插入到人的基因组AAVS1位点,这个位点是一个开放位点,支持转基因长期稳定的表达,破坏这个位点对细胞没有不良影响,因此被广泛利用。
几种主要的基因编辑技术
同源重组(HomologousRecombination, HR)
早期的基因编辑技术可以追溯到同源重组这种方法。基于同源重组的基因编辑被称为基因打靶或基因靶向技术(gene targeting)。例如依赖大肠杆菌细胞内的RecA或酵母的RAD54重组酶,基因靶向技术可以对目标基因或基因的部分序列进行替换、删除,或在细胞内存在同源序列的情况下插入外源DNA序列。运用同源重组对基因进行编辑的方法已经在微生物、植物和动物中取得了成功。不过,该方法的一个主要局限在于重组频率低,在实践上难以广泛应用。
锌指核酸酶(ZincFinger Nuclease, ZFN)
人工核酸酶 ZFN 可以算是第一种具有普遍适用性的基因编辑技术。锌指核酸酶是按人工核酸酶是利用IIS 型核酸内切酶特点组件的原理而构建。这种锌指核酸酶就是由一系列锌指结构单元与Fok I的核酸酶切活性区域组合而成的。它具有对特定的DNA序列进行识别和切割的能力。ZFN对不同DNA序列识别的机理在于组成其锌指蛋白基元(Motif)的种类及排列方式。
ZFN 这种基因编辑方法在一系列的模式生物中都获得了成功。研究显示 ZFN 基因编辑效率约为 30%,相对于同源重组,其编辑效率无疑具有了质的提高。不过,目前它还存在一些不足,一个突出的问题是所谓的脱靶效应,即合成的核酸酶并没有对预先设定的目标DNA序列进行识别和切割。
ZFN 核酸酶结构及其工作原理示意图
该技术一直以来被Sangamo生物公司所垄断,该公司只与部分科研机构合作。现在这种形势得到了改变,一个由八个实验室组成的协会,在分子生物学家J. Keith Joung的带领下,提出了制造ZFN的一种开源方式(Maeder et al., 2008)。该组织建立了66个“锌指”库,选择性地针对不同的DNA序列。从库中建立的“锌指核酸酶”在测试一个植物基因和三个人类基因时大概有1-50%的高效率,这种效率可以与Sangamo、经典基因立法相媲美。
转录激活子样效应因子核酸酶TALEN (Transcription Activation Like Effector Nuclease)
在ZFN问世不久,另一种人工核酸酶TALEN也被开发出来。TALEN是基因组编辑核酸酶三大类之一。它是实现基因敲除、敲入或转录激活等靶向基因组编辑的里程碑。TALENs由于具有一些比锌指核酸酶(ZFNs)更优越的特点,现在成为了科研人员用于研究基因功能和潜在基因治疗应用的重要工具。是目前较有发展前景的基因修饰技术。
TALEN 结构及组成示意图
TALENs中文名是转录激活因子样效应物核酸酶,TALENs是一种可靶向修饰特异DNA序列的酶,它借助于TAL效应子一种由植物细菌分泌的天然蛋白来识别特异性DNA碱基对。TAL效应子可被设计识别和结合所有的目的DNA序列。对TAL效应子附加一个核酸酶就生成了TALENs。TAL效应核酸酶可与DNA结合并在特异位点对DNA链进行切割,从而导入新的遗传物质。TALEN原理简单、并且理论上说对任意的核苷酸序列,都能以它为靶标构建一个特异的TALEN核酸酶。在编辑效率方面,TALEN也还没有达到理想的程度。
ClusteredRegularly Interspaced Short Palindromic Repeats/CRISPR-Associated Proteins, CRISPR
如果说 ZFN 和 TALEN 技术的出现使基因编辑研究获得了很大的成功,那么最近的CRISPR则让这一领域的发展产生了飞跃。
CRISPR是生命进化历史上,细菌和病毒进行斗争产生的免疫武器,简单说就是病毒能把自己的基因整合到细菌,利用细菌的细胞工具为自己的基因复制服务,细菌为了将病毒的外来入侵基因清除,进化出CRISPR系统,利用这个系统,细菌可以不动声色地把病毒基因从自己的染色体上切除,这是细菌特有的免疫系统。
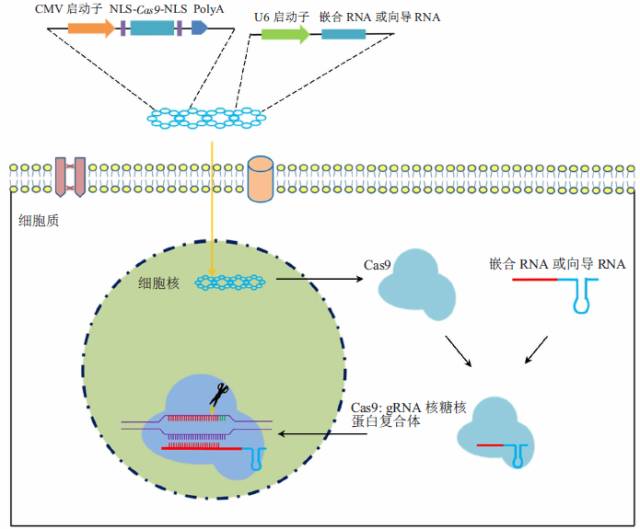
CRISPR/Cas9技术敲除掉部分基因原理图
微生物学家10年前就掌握了细菌拥有多种切除外来病毒基因的免疫功能,其中比较典型的模式是依靠一个复合物,该复合物能在一段RNA指导下,定向寻找目标DNA序列,然后将该序列进行切除。许多细菌免疫复合物都相对复杂,其中科学家掌握了对一种蛋白Cas9的操作技术,并先后对多种目标细胞DNA进行切除。这种技术被称为CRISPR/Cas9基因编辑系统,迅速称为生命科学最热门的技术。
对比人工核酸酶和CRISPR/Cas9系统可以发现,CRISPR/Cas9的优势主要体现在两个方面:一是用于基因敲除的CRISPR载体构建极其简单,只需要根据推荐的序列合成spacer并将其整合进载体,就完成了基因编辑载体体外的操作过程;二是CRISPR/Cas9与DNA靶序列结合有更高的特异性。除此之外,相对于同源重组,CRISPR不仅有更高的效率,适应范围也更加广泛。
目前的研究表明该技术适合从原核生物到高等动植物在内的所有生物类群,而且,对CRISPR的酶切基团进行诱变后可以对DNA进行单链切割以及可以同时进行多基因或单基因的多靶点编辑。
早在2000年,人类基因组的草图就已经基本绘制完成,但十几年来,揭示这些基因的具体功能和作用的研究并没有取得突破性的进展。其中一个重要的原因就在于,以往进行基因编辑的技术操作过程复杂、耗费昂贵等。而现在,这一切都因CRISPR/Cas9技术的出现而发生着巨大的改变。
文 | 布拉德皮蛋
转载请注明来源:贝壳社(微信号:iBio4P)
· END ·