基因检测与肿瘤的个性化治疗
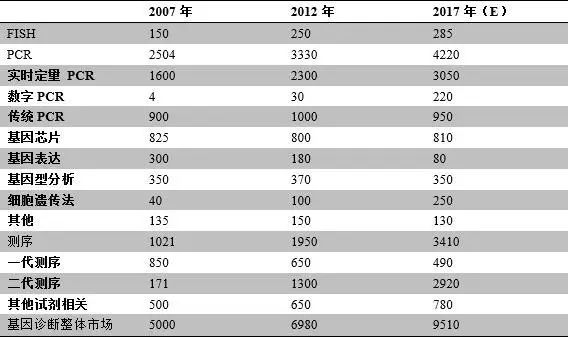
基因检测是指运用分子生物学方法及信息学技术,分析基因序列,检测患者体内遗传物质的结构、内容等变化,从而做出疾病诊断或疾病风险预测的技术。常用的基因诊断技术包括聚合酶链式反应、转录介导的扩增、荧光原位杂交、基因测序以及基因芯片技术等。基因检测已经广泛应用于遗传病筛查、产前诊断、感染性疾病和公共卫生监测等领域。几乎每个领域的市场容量及增长率都非常惊人(表1)。
表1 全球基因检测主要技术的细分市场规模(百万美元)
肿瘤常用基因检测方法
肿瘤基因检测是增长最快的领域之一。全球癌症患者和死亡病例增长令人不安。新增癌症病例有近一半出现在亚洲,其中大部分在中国,我国新增癌症病例高居第一位。从美国精准医疗的发展来看,肿瘤治疗正逐渐从宏观层面对“症”用药向更微观的对基因用药转变,实现“同病异治”或“异病同治”,基因检测和个体化已经成为肿瘤治疗的公认趋向。肿瘤基因检测方法包括Sanger测序法、高通量测序法、扩增阻滞突变系统(ARMS)-PCR法、高分辨率熔解曲线(HRM)法、荧光原位杂交(FISH)等方法。
Sanger测序法是一种通过直接读取DNA的序列检测检测已知和未知突变的方法,每次可以对16-96个不同DNA片段进行检测,DNA测序长度可以达到500-1000个碱基,由于技术比较成熟,也被认为基因检测的金标准。这一方法的局限性是灵敏度不高,对样本中肿瘤细胞的含量和比例要求较高,一般要求肿瘤细胞含量不低于50%,否则假阴性出现的概率会显著增加,因此对于活检标本或细胞学样本并非最佳检测方法。
高通量测序法也是一种直接读取DNA序列的方法,但可以对几百万甚至十亿条DNA进行序列分析,不同测序仪可以获得测序读长从几十碱基到几百碱基不等。该技术不仅仅拓展了可以一次检测的肿瘤基因数量,对一个肿瘤患者样本可以同时完成几个至上百个肿瘤相关基因检测。同时,这一技术也提升了检测灵敏度,可以对标本中肿瘤细胞比例在千分之一水平的标本进行检测。检测灵敏度与测序深度以及测序错误率直接相关。这一技术作为新一代基因检测技术的一个重要应用,具有较好的发展潜力,但目前相对来说检测价格比较昂贵;此外,检测获得信息较多,需要科研和临床密切配合才能提供更加有效的临床解读。
扩增阻碍突变系统(amplificationrefractory mutation system, ARMS-PCR)也称等位基因特性PCR(allele-specificPCR, AS-PCR),用于对已知突变基因进行检测,是目前最为常用的基因突变检测方法。ARMS-PCR法检测灵敏度高且检测周期短,可检测肿瘤细胞中突变比例1%甚至更低的突变基因;该方法也存在一定局限性,只能检测已知的突变类型,不能发现一些新的、未知的突变。
荧光原位杂交(fluorescencein situ hybridization, FISH)是通过荧光标记的特定DNA探针与细胞核内的DNA靶序列杂交,并在荧光显微镜下观察的一种分子细胞遗传学技术。主要可对基因缺失、基因融合、基因扩增进行检测,也可用于检测染色体畸变等。由于操作复杂、检测通量较低,难以广泛应用。
随着科学发展,人类对疾病认识在不断深入,很多肿瘤发生的基因组学基础得以明确。这些新知识丰富了基因检测的目标基因,也为疾病防控提供了科学基础。以妇科生殖道肿瘤疾病为例,其中子宫颈癌、子宫内膜癌、卵巢癌位居前三位,是严重危害妇女生命健康的三大恶性肿瘤。其中宫颈癌通过广泛推广HPV普查普治,早期预防工作取得显著成效,发病率和死亡率在一定程度上已大幅下降。子宫内膜癌的发病有明显上升和年轻化趋势,相对于卵巢癌发病率高,而卵巢癌的死亡率较高。在这三种妇科肿瘤中,除了众所周知的癌基因,新的癌基因也不断被发现。如在子宫内膜癌中发生的复发性体细胞突变基因有ARID1A, INHBA, KMO, TTLL5, GRM8, IGFBP3, AKTIP, PHKA2, TRPS1, WNT11,ERBB3 和 RPS6KC1等。科学研究也发现三种基因CHD4,MB3,TAF1导致子宫浆液性癌突变,其中CHD4, MB3在基因组重塑中发挥作用,TAF1是负责人类基因组中大部分蛋白质编码基因转录的核心元件。这些新的肿瘤相关基因都有可能作为检测宫颈癌,子宫内膜癌和卵巢癌中的目标基因。
基因检测与个性化治疗相结合
无论是液体活检还是肿瘤早早筛,对患者而言都需要提高治疗效率,延长生存周期。要实现这一目标,必须将肿瘤基因检测和个体化治疗相结合。肿瘤个体化治疗不同于传统治疗,需要充分考虑病患个体异质性,针对每个肿瘤患者的基因、环境、生活方式,系统性确定治疗方案。通过肿瘤个体化医疗能有效地制定出兼顾最佳治疗效果和最优医疗成本效益比的治疗方案,使患者的治疗更有效、副作用更低,改善医患关系;同时有利于降低制药企业的研发成本,开发出更有针对性的药物;对于肿瘤患者来讲,更是减少了治疗的经济负担,提高了存活率。
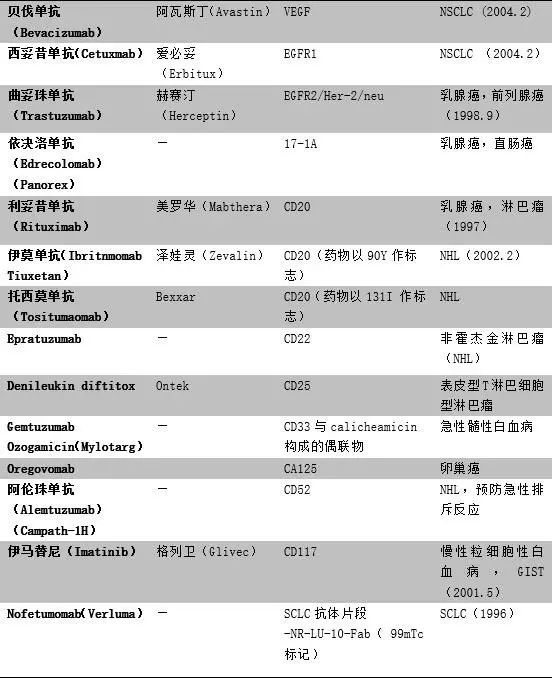
2001年,络氨酸激酶抑制剂格列卫(Glevec)获得美国食品药品监督局批准上市,用于治疗慢性髓性白血病。格列卫是第一个面市的癌症分子靶向药物。目前,美国食品药物管理局已批准在140余种药物的药品标签中增加药物基因组信息,涉及的药物基因组生物标记物达42个(表2)。药物反应相关基因及其表达产物的分子检测是实施个体化药物治疗的前提,形成了基因检测和治疗的闭环。据WHO预测,全球癌症发病率将从2012年的1400万增加到2030年的2220万人以上,早期诊断以及有效的治疗方案,预计可为全球带来至少数千亿美元的产业收入。
表2 部分FDA批准的基因诊断肿瘤个体化治疗方案
如上表所示,在乳腺癌患者中25%的患者是由HER2基因突变所致,而另外75%的患者是由其他单个或多个基因的突变造成的。基因泰克公司的靶向单抗药物赫赛汀对携带HER2基因突变的患者具有较好的治疗效果。通过HER2基因突变检测来确定患者是否可以接受赫赛汀治疗,可明确25%可治疗患者,其余75%的患者则需要选择治疗方案。在治疗前进行基因检测可以很好地指导对症下药,提升治疗效率。
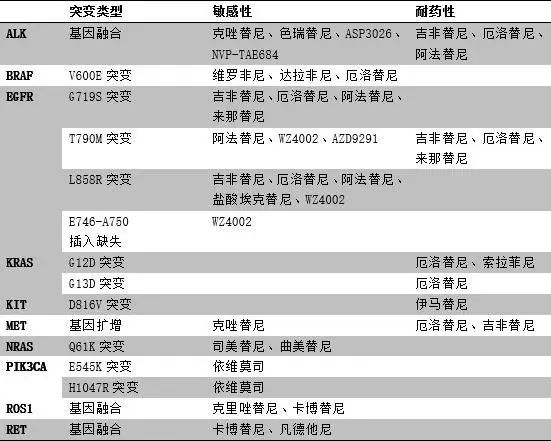
肺癌是严重危害人类健康的一种恶性肿瘤,在我国发病率居所有恶性肿瘤首位。从组织学上说,肺癌分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。在肺癌患者中,约85%-90%为非小细胞肺癌。研究表明,约70%-80%的非小细胞肺癌患者对吉非替尼治疗无效,其中约50%的患者是由于EGFR基因第790位苏氨酸突变为蛋氨酸(T790M突变)导致的原发性耐药。因此,肿瘤个体化治疗成为非小细胞肺癌的重要治疗手段之一(表3)。现在可以将同一种肿瘤相关的个性化治疗药物开发成为基因组合检测(gene panel),一次性完成肿瘤个性化治疗相关基因检测,根据综合的基因检测结果给出最佳治疗方案,为患者有效治疗争取宝贵时间。
表3 肺癌个体化治疗相关药物
2015年7月,国家卫生计生委个体化医学检测技术专家委员会制定并发布了《药物代谢酶和药物作用靶点基因检测技术指南(试行)》和《肿瘤个体化治疗检测技术指南(试行)》。美国临床肿瘤学会(ASCO)也已经发布了多种肿瘤分子检测指南,建议在肺癌患者中选择治疗靶点表皮生长因子受体(EGFR)和间变性淋巴瘤激酶(ALK)分子检测;美国临床肿瘤协会(ASCO)发表结直肠癌分子检测指南,对RAS突变进行药物治疗指导,使用BRAF V600突变检测、缺陷错配修复(dMMR)/微卫星不稳定性(MSI)用来进行预后分层。这些临床指南发布不仅仅使临床医生开展各种基因检测具有明确依据,同时对检测标准建立、检测质量保证都有了明确建议,保证了检测结果的准确性和一致性,对于推广肿瘤基因检,实现个体化治疗,提高疗效,减轻不良反应,促进医疗资源的合理利用提供了有力保障。