7月份4篇Nature、1篇Science等多文关注CRISPR/Cas重大突破
本文系生物谷原创编译,欢迎分享,转载须授权!
基因组编辑技术CRISPR/Cas9被《科学》杂志列为2013年年度十大科技进展之一,受到人们的高度重视。CRISPR是规律间隔性成簇短回文重复序列的简称,Cas是CRISPR相关蛋白的简称。CRISPR/Cas最初是在细菌体内发现的,是细菌用来识别和摧毁抗噬菌体和其他病原体入侵的防御系统。
即将过去的7月份,有哪些重大的CRISPR/Cas研究或发现呢?谷君梳理了一下这个月生物谷报道的CRISPR/Cas研究方面的新闻,供大家阅读。
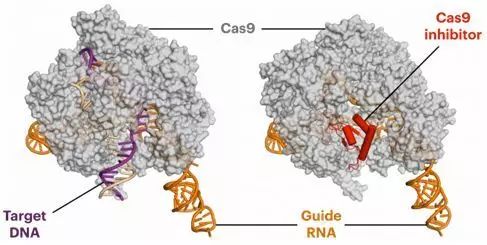
1.Science:从结构上揭示CRISPR/Cas系统的Cas1-Cas2整合酶发现靶DNA机制
doi:10.1126/science.aao0679
蛋白IHF(蓝色)在CRISPR短回文重复序列的上游产生一种个急转弯,从而允许Cas1-Cas2(绿色和黄色)识别和结合插入位点。图片来自Addison Wright, UC Berkeley。
CRISPR/Cas系统是在很多细菌中发现的一种免疫系统。在细菌中,这种系统依赖Cas1-Cas2整合酶捕获和整合短的外源DNA片段到它们的基因组中的CRISPR位点上,从而能够抵抗相同病毒的再次入侵。
在一项新的研究中,来自美国加州大学伯克利分校的研究人员发现Cas1-Cas2如何找出它们将病毒DNA片段插入到细菌基因组中的这个位点,这样Cas1-Cas2随后就能够识别这种病毒DNA片段和发起攻击。相关研究结果于2017年7月20日在线发表在Science期刊上,论文标题为“Structures of the CRISPR genome integration complex”。
论文通信作者Jennifer Doudna和她的研究团队利用电子显微技术和X射线晶体分析技术捕获到Cas1-Cas2将病毒DNA片段插入到细菌基因组的CRISPR区域中时的结构图。
这些结构图揭示出第三种蛋白IHF(在Cas1-Cas2整合酶中,Cas1是第一种蛋白,Cas2是第二种蛋白)结合到这个插入位点的附近,让靶DNA弯曲成一种U形结构,从而允许Cas1-Cas2同时结合到靶DNA的两个末端上。
2.Nature:利用体内CRISPR-Cas9筛选技术发现新的药物靶标来增强癌症免疫疗法
doi:10.1038/nature23270
在一项新的研究中,来自美国达纳-法伯癌症研究所和波士顿儿童医院癌症与血液疾病中心等研究机构的研究人员开发出一种新的筛查方法,即利用CRISPR-Cas9基因组编辑技术在小鼠体内测试上千个肿瘤基因的功能。他们利用这种方法揭示出新的药物靶标,从而可能潜在地改进PD-1检查点抑制剂(一类新的有前景的癌症免疫疗法)的疗效。相关研究结果于2017年7月19日在线发表在Nature期刊上,论文标题为“In vivo CRISPR screening identifies Ptpn2 as a cancer immunotherapy target”。论文通信作者为小儿科肿瘤学家W. Nick Haining博士。
论文第一作者、Haining实验室研究生Robert Manguso设计出一种基因筛选系统来鉴定癌细胞用来躲避免疫攻击的基因。他利用CRISPR-Cas9系统性地敲除黑色素瘤(一种皮肤癌)细胞表达的2368个基因。CRISPR-Cas9像一把分子剪刀那样发挥作用,在遗传密码的特定位点准确地切割DNA。Manguso随后能够鉴定出哪些基因当被剔除时会使得这些癌细胞对PD-1阻断更加敏感。
通过注射这些肿瘤细胞到小鼠体内和利用PD-1检查点抑制剂治疗这些小鼠,Manguso随后能够统计哪些接受编程的肿瘤细胞存活下来。那些死掉的肿瘤细胞因发生基因缺失而对PD-1阻断敏感。 利用这种方法,Manguso和Haining首次证实了已知的两种免疫逃避基因(PD-L1和CD47)的作用,靶向它们的抑制剂药物已用于临床试验中。他们随后发现许多新的免疫逃避基因,如果通过治疗手段加以抑制,就能够改进PD-1癌症免疫疗法。特别令人关注的是,其中的一个新发现的基因是Ptpn2。
3.Nature:重大突破!发现III型CRISPR-Cas系统新的作用机制
doi:10.1038/nature23467
在一项新的研究中,瑞士苏黎世大学的Martin Jinek领导的一个国际研究团队史无前例地发现细菌保护自己免受侵入性病毒攻击的一种新的防御机制。当遭受入侵时,作为细菌免疫系统的CRISPR-Cas系统产生一种化学信号来激活第二种酶,从而协助降解这些入侵者的遗传物质。这一过程非常类似于人先天性免疫系统的一种抗病毒机制。相关研究结果于2017年7月19日在线发表在Nature期刊上,论文标题为“Type III CRISPR–Cas systems produce cyclic oligoadenylate second messengers”。
CRISPR-Cas系统的这种靶向复合物由源自规律间隔性成簇短回文重复序列(clustered regularly interspaced short palindromic repeats, CRISPR)的RNA序列(即crRNA)和CRISPR相关蛋白(CRISPR-associated proteins, Cas)组成。crRNA识别入侵性病毒的遗传物质,而Cas蛋白像一把分子剪刀那样切割它。在CRISPR-Cas系统的一个亚型(被称作III型CRISPR-Cas系统)中,该团队取得一项令人吃惊的发现。当这种靶向复合物识别入侵性病毒时,它合成“第二种信使”:一种小的环状RNA分子,即环寡腺苷酸(cyclic oligoadenylate)。这种信号分子能够在细菌细胞内扩散,激活另一种被称作Csm6的RNA降解酶,这种RNA降解酶协助破坏这种病毒的RNA。
4.Blood:利用CRISPR引入有益的血红蛋白突变,有望治疗危及生命的血液疾病
doi:10.1182/blood-2017-02-767400
图片来自CC0 Public Domain
在一项新的研究中,来自澳大利亚新南威尔士大学、日本理化学研究所生物资源中心和日本红十字会的研究人员利用基因编辑技术CRISPR将一种有益的自然突变引入到血细胞中,能够开启胎儿血红蛋白(foetal haemoglobin)产生,这一进展可能最终导致人们开发出治愈镰状细胞性贫血和其他的血液疾病的方法。相关研究结果于2017年7月18日在线发表在Blood期刊上,论文标题为“KLF1 drives the expression of fetal hemoglobin in British HPFH”。
作为一种至关重要的分子,成人血红蛋白在肺部获得氧气,将它运送到全身各处。地中海贫血或镰状细胞性贫血患者具有缺陷性的成人血红蛋白(adult haemoglobin),因而他们需要终生接受血液灌注和药物治疗。然而,患有这些疾病的病人如果也携带一种有益的被称作British-198的自然突变,那么他们具有减少的症状,这是因为这种突变开启正常情形下在出生后就会被关闭的胎儿血红蛋白产生。
论文通信作者、新南威尔士大学分子生物学教授Merlin Crossley说,“利用CRISPR基因编辑技术,我们如今能够准确地切割和改变我们的巨大的基因组内的单个基因。我们的实验室证实利用这种技术将这种有益突变British-198引入到血细胞中可显著地提高它们的胎儿血红蛋白产生。”
5.Nat Med:利用CRISPR/Cas9恢复肌肉功能
doi:10.1038/nm.4367
在一项新的研究中,研究人员利用CRISPR在小鼠体内成功地治疗一种被称作先天性肌营养不良1A型(congenital muscular dystrophy type 1A, MDC1A)的罕见疾病。这种疾病能够导致严重的肌肉萎缩和瘫痪。他们能够通过校正一种导致这种疾病的剪接位点突变恢复了这些小鼠的肌肉功能。相关研究结果于2017年7月17日在线发表在Nature Medicine期刊上,论文标题为“Correction of a splicing defect in a mouse model of congenital muscular dystrophy type 1A using a homology-directed-repair-independent mechanism”。
加拿大多伦多病童医院研究员Dwi Kemaladewi在一项声明中解释道,“我们利用CRISPR切割两个关键位点上的DNA,而不是插入已得到校正的DNA片段。这会导致基因的两个末端一起恢复原状,从而产生一个正常的剪接位点。”
通过靶向骨骼肌和外周神经,这些研究人员能够改善这些小鼠的运动功能和移动能力。Kemaladewi在一份新闻稿中说道,“这是比较重要的,这是因为开发治疗肌营养不良的策略主要集中在改善这些肌肉性能。专家们知道外周神经是较为重要的,但是骨骼肌被认为是导致MDC1A的元凶,而且传统上是开发治疗方案的重点。”
6.Science子刊:利用抗CRISPR蛋白显著降低CRISPR-Cas9脱靶效应
doi:10.1126/sciadv.1701620
图片来自Fuguo Jiang/UC Berkeley.
如今有研究证实病毒进化出的反制措施,即被称作抗CRISPR蛋白(anti-CRISPR)的抑制性蛋白,能够被用来改进作为一种基因治疗工具的CRISPR-Cas9,从而降低可能导致不良副作用的脱靶基因编辑。
在一项新的研究中,来自美国加州大学伯克利分校和加州大学旧金山分校的研究人员证实最近发现的抗CRISPR蛋白降低脱靶效应多达4倍,就像一种切断开关那样让CRISPR-Cas9完成它的任务之后失去功能。相关研究结果发表在2017年7月12日的Science Advances期刊上,论文标题为“Disabling Cas9 by an anti-CRISPR DNA mimic”。论文通信作者为加州大学伯克利分校创新基因组学研究所研究员Jacob Corn博士和来自加州大学伯克利分校的作为CRISPR-Cas9基因编辑发明人之一的Jennifer A. Doudna。
在这项研究中,这些研究人员让CRISPR-Cas9分子利用向导RNA(gRNA)发现、切割和替换导致镰状细胞疾病的血红蛋白编码基因突变体。他们证实一种被称作AcrIIA4的特定抗CRISPR蛋白将这种CRISPR-Cas9分子的脱靶效应降低4倍。它在做到这一点的同时不会显著地降低想要的在靶基因编辑。
7.Nature:重磅!利用CRISPR–Cas系统将数字视频存储到一群细菌的基因组中
doi:10.1038/nature23017
如今,在一项新的研究中,Church团队在基础的概念验证实验中证实CRISPR系统能够编码与人类数字化视频一样复杂的信息,这就让人想起早期的人类在洞穴壁表面上绘制的一些图画。他们在活细胞中编码了一部视频短片,该短片的内容是一个人骑着马狂奔时的场景。相关研究结果于2017年7月12日在线发表在Nature期刊上,论文标题为“CRISPR–Cas encoding of a digital movie into the genomes of a population of living bacteria”。
CRISPR系统有助细菌在它们的不同环境中对持续的病毒攻击产生免疫力。作为在感染中存活下来的记忆,这些细菌捕获病毒DNA分子,利用它们产生短的所谓的“间隔”序列,并且将这些间隔序列作为新的序列元件添加到不断增加的位于细菌基因组中的CRISPR阵列内。到目前为止,当相同的病毒再次入侵时,CRISPR-Cas9蛋白持续地利用这些间隔序列摧毁它们。然而,除了在基因组工程工具中广泛使用的Cas9之外,CRISPR系统的其他部分迄今为止并没有在技术上得到太多的利用。
Church说,“在这项研究中,我们证实我们将CRISPR系统的两种蛋白Cas1和Cas2设计为一种分子记录工具,而且随着对最佳的间隔序列的序列需求获得的新认识,这种分子记录工具能够显著地扩大获得记忆(即能够由研究人员从外面提供的或者在未来可能由来自细胞的自然经历形成的信息)和在基因组中储存它们的潜力。通过进一步使用,这种方法可能给天然的组织环境中的不同活细胞类型提供线索,从而将它们正在经历的变化记录在它们的基因组上系统性构建的存储热点中。”
为了在更大规模上着手处理复杂信息,Church团队求助于静止图片和移动图片,这是因为它们代表着约束的明确定义的数据集,而视频让细菌有机会获得按照时间顺序发生逐帧变化的信息。论文第一作者Seth Shipman说,“我们设计出策略,将一张图片或一帧的每个像素中含有的数字信息和帧编号转化为DNA密码,并且将这种密码与其他的序列一起整合到间隔序列中。我们随后将针对按照时间顺序排列的连续帧设计的间隔序列集合提供给一群细菌,并且是利用Cas1/Cas2活性将这种间隔序列集合添加到它们的基因组中的CRISPR阵列上。在利用DNA测序再次取回来自这种细菌群体中的所有CRISPR阵列之后,我们最终能够重建一个人骑着马狂奔视频短片的所有帧,并且是按照这些帧出现的顺序进行重建。”
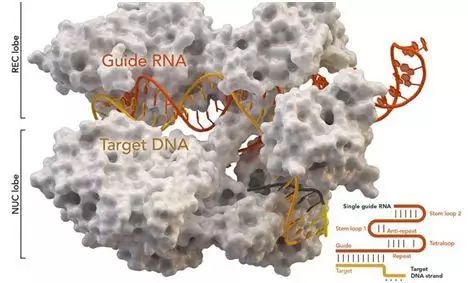
8.Nature:从结构上揭示CRISPR-Cpf1的DNA靶向机制
doi:10.1038/nature22398
图片来自University of Copenhagen。
在一项新的研究中,来自丹麦哥本哈根大学的研究人员发现了一种新的被称作Cpf1的分子剪刀如何让DNA解链,并对它进行切割。这个CRISPR-Cas家族成员表现出较高的准确性,能够像全球定位系统(GPS)那样发挥作用以便鉴定出基因组中的靶位点。Cpf1的高精准度将会改进这种技术在修复基因损伤、其他医学应用和生物技术应用上的使用。
这些研究人员成功地可视化观察和描述了Cpf1的工作方式。这种蛋白属于Cas家族,能够切割双链DNA,因而允许启动这种基因组修饰过程。相关研究结果发表在2017年6月22日的Nature期刊上,论文标题为“Structure of the Cpf1 endonuclease R-loop complex after target DNA cleavage”。论文通信作者为哥本哈根大学研究员Guillermo Montoya和Stefano Stella。
全世界的科学家们正在努力优化这种基因组编辑技术以便让它变得更加精准和更加高效。为了实现这一点,科学家们也关注特异性地切割DNA的其他蛋白,如Cpf1,对这些蛋白进行操纵能够将它们引导到基因组中的特定位点上。Montoya团队利用X射线衍射晶体分析技术成功地解析出控制这种过程的分子机制。
Montoya说,“我们利用X射线照射Cpf1蛋白晶体,能够在原子分辨率上观察到它的结构,从而能够让我们观察它的所有组分。X射线衍射是被用来解析生物分子结构的主要生物物理学技术之一。”
9.Cell:重磅!科学家开发出基于CRISPR的新技术 或有望开发更为安全的基因编辑疗法
doi:10.1016/j.cell.2017.05.044
日前,一项刊登在国际著名杂志Cell上的一篇研究报告中,来自美国德克萨斯大学(The University of Texas)的研究人员通过研究利用CRISPR开发出了新型的基因编辑疗法来治疗危及生命的疾病,比如癌症、HIV和亨廷顿氏症等。
文章中,研究人员开发了一种新方法,其能够通过个体的完整基因组来快速检测CRISPR分子,从而预见除了CRISPR的靶点外其是否还能够同其它DNA片段相互作用,这种新方法或许就能够帮助临床医生为患者制定个体化的基因疗法,同时还能够保证疗法的安全性和有效性。Ilya Finkelstein教授说道,你和我之间或许会出现大约100万个点的差异,由于这种遗传多样性的存在,对人类基因的编辑似乎总是一种需要进行定制化的疗法。
研究人员就采用了一种DIY的方法来开发新型设备和软件,他们利用当前的实验室技术开发出了名为CHAMP的技术平台(Chip Hybridized Affinity Mapping Platform,音译:芯片杂交亲和映射平台),这项检测的核心就在于其是能够用于研究和医学中的新一代标准化的基因测序芯片,其中还有两个关键元件也是开放源,即能够在显微镜下抓住芯片的3-D打印底板和用于分析结果的软件,因此,其它研究人员就能够在实验室中轻松复制出设计CRISPR的技术。
10.Cell:重大突破!首次从结构上揭示CRISPR-Cas3系统作用机制
doi:10.1016/j.cell.2017.06.012
在一项新的研究中,来自美国哈佛医学院和康奈尔大学的研究人员获得来自嗜热裂孢菌(Thermobifida fusca)的I型CRISPR复合体的近原子分辨率的图片,揭示出它的作用机制的关键步骤。这些发现提供改善CRISPR在生物医学应用时的效率和准确性所需的结构数据。相关研究结果发表在2017年6月29日的Cell期刊上,论文标题为“Structure Basis for Directional R-loop Formation and Substrate Handover Mechanisms in Type I CRISPR-Cas System”。论文通信作者为哈佛医学院细胞生物徐助理教授Maofu Liao和康奈尔大学研究员Ailong Ke。
这些研究人员利用冷冻电子显微镜技术首次描述出当这种CRISPR复合体装载靶DNA并让它做好被Cas3酶切割的准备时准确发生的一系列事件。他们说,这些结构揭示出一种存在多层错误检测的过程,即存在阻止不想要的基因组损伤的分子冗余(molecular redundancy)。
为了更好地理解CRISPR-Cas如何发挥功能,Liao、Ke和他们的团队着重关注细菌中最常见的CRISPR亚型:1型CRISPR,即利用一种被称作CRISPR Cascade的核糖蛋白复合体(riboprotein complex)捕获DNA,并且利用酶Cas3切割外源DNA。
通过联合使用生化技术和冷冻电子显微镜技术,他们复原出在不同的功能状态下的稳定的Cascade,并且进一步获得Cascade在捕获和加工DNA时分辨率低至3.3埃(大约是一个碳原子直径的3倍)的图片。
在CRISPR-Cas3中,crRNA被装载到CRISPR Cascade上,随后寻找一段非常短的表明外源病毒DNA存在的DNA序列(被称作PAM)。
Liao、Ke和他们的同事们发现当Cascade检测PAM序列时,它让DNA呈锐角弯曲,迫使一小段DNA解链。这允许crRNA的一个长11nt的片段结合到靶DNA链上,形成一种“种泡(seed bubble)”。
这种种泡发挥一种自动防故障装置的作用,检查靶DNA是否匹配crRNA。如果它们正确地匹配,那么这种种泡就会扩大,crRNA的剩余部分就与它对应的靶DNA结合,形成一种“R环(R-loop)”结构。
一旦这种R环完全形成,这种CRISPR Cascade复合体经历一种构象变化,从而将靶DNA锁定。它也让DNA的第二条非靶标链产生一个凸起,这个凸起被移交到这种CRISPR Cascade复合体的一个不同位置上供Cas3酶切割。
仅当一种完整的R环形成时,Cas3酶才结合和切割在这条非靶标DNA链上产生的这个凸起上的DNA。
这些发现揭示出一种精心设计的分子冗余确保精准切割和避免错误地切割细菌自己的DNA。
11.Nat Commun:利用CRISPR-Cas9阻止视网膜中的血管生成,有望治疗多种眼部疾病
doi:10.1038/s41467-017-00140-3
图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)
血管生成(angiogenesis)导致视力丧失和失明,是增殖性糖尿病视网膜病变(proliferative diabetic retinopathy, PDR)、湿性年龄相关性黄斑变性(Wet age-related macular degeneration, AMD)和早产儿视网膜病变(retinopathy of prematurity, ROP)等几种退行性眼部疾病的一种特征。
在一项新的研究中,来自美国麻省眼耳医院斯格本斯眼科研究所的研究人员利用基因编辑技术CRISPR-Cas9成功地阻止视网膜中的血管生成,这可能导致人们为以病理性眼球内血管生成为特征的眼部疾病开发出新的疗法。相关研究结果于2017年7月24日在线发表在Nature Communications期刊上,论文标题为“Genome editing abrogates angiogenesis in vivo”。
这些研究人员利用腺相关病毒(AAV)运送靶向VEGFR2的CRISPR-Cas9系统。VEGFR2是导致血管生成的一种至关重要的蛋白。单次注射这种系统能够阻止临床前模型中的视网膜血管生成。
12.Mol Cell:CRISPR靶向序列文库增强这种基因编辑方法的力量
doi:10.1016/j.molcel.2017.06.030
作为一种在生物学中比较流行的基因编辑技术,CRISPR如今比以前任何时候都要更强大。在一项新的研究中,英国研究人员构建出一种能够被用来引导CRISPR-Cas9复合体史无前例地精准地切割DNA的CRISPR靶向序列文库。
此外,这些研究人员开发出一种多重sgRNA(单向导RNA)表达策略,该策略促进单个基因功能性剔除和允许组合靶向。通过结合这些策略,他们设计和构建一种全基因组的序列验证的阵列CRISPR文库。
相关研究结果发表在2017年7月20日的Molecular Cell期刊上,论文标题为“A CRISPR Resource for Individual, Combinatorial, or Multiplexed Gene Knockout”。